|
d'après agrégation interne 99
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
coupellation du plomb argentifère |
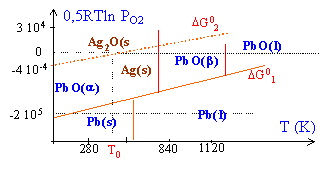
oxydation à 1100°C par un violent courant d'air de l'alliage enrichi de plomb et d'argent fondu dans une coupelle. On sépare facilement l'oxyde de plomb de l'argent. Le diagramme d'Ellingham du plomb rapporté à ½ mole de O2 est dessiné ci dessous. [ordonnée : enthalpie libre en J mol-1] 
température de fusion Ag : 1235 K; Pb: 600K; PbO(b): 1159 K; Ag2O: >1400K
corrigé |
|||||||||||||||||||||
|
|
Pb(s) + 0,5 O2 --> PbO (a) DH01 = -219 kJ mol-1 ; S01 = 66,5 -102,4-64,8 = -100,7 J K-1 mol-1. DG01 = -219 +100,7 10-3 T kJ mol-1. Pb(l) + 0,5 O2 --> PbO (a) DG01 = -224,1 +100,7 10-3 T kJ mol-1. 2Ag(s) + 0,5 O2 --> Ag2O(s) DH02 = -31 kJ mol-1 ; S02 = 121,3 -85-102,4 = -66,1 J K-1 mol-1. DG0 2 = -31 + 66,1 10-3 T kJ mol-1. oxydation préférentielle du plomb à toute température. à 1100°C, PbO surnage (densité=8) et l'argent est en dessous (densité 10,5): une extraction est donc possible. droite isobare : y =0,5 RT ln(PO2 / P0)= 0,5 *8,31 T ln(0,2) pour l'air y= -6,69 10-3 T droite quasiment horizontale passant par 0. Cette droite coupe la frontière Ag2O / Ag à T0=426K. l'argent s'oxyde lentement à l'air (métal précieux utilisé en bijouterie, argenterie, électricité). Par contre au delà de 426K (153°C) la couche d'oxyde est détruite.
|
|||||||||||||||||||||
|
la cyanuration |
corrigé |
|||||||||||||||||||||
|
sans agent complexant : 4Ag+ +4 e- <==> 4Ag (1) E1=0,8 +0,06/4 log [Ag+]4 O2+4e- +4H+ <==> 2H2O(2) E2=1,23 -0,06/4 log [PO2] * [H+]4 (2)-(1) : log K21 = (1,23-0,8)*4/0,06 = 28,66 2H2O <==> 4HO-+4H+.log Ke=-14*4 =-56 4Ag +O2 +2H2O <==> 4HO-+4Ag+ avec log K3=-56+28,6 = -27,4 DrG03 = 27,4*2,3*8,3*298 = 156 kJ mol-1. réaction non spontanée de gauche à droite: Ag est stable avec agent complexant : 4Ag+ +8CN- <==> 4Ag(CN)2- avec log K= 4 log b=84,4 et DrG04 = -RTln b4= -481 kJ mol-1. 4Ag +8CN-+O2 +2H2O <==> 4HO-+4Ag(CN)2- avec logK=84,4-27,4 = 57 et DrG0 =-481+156 = -325 kJ mol-1 : spontanée. 2Ag+ +2 e- <==> 2Ag (1) E1=0,8 +0,03 log [Ag+]2 et DrG01 =-2FE1. Zn2+ +2e- <==> Zn (2) E2= -0,76 + 0,03 log [Zn2+ ] et DrG02 =-2FE2. Zn + 2Ag+<==> 2Ag +Zn2+ (-2)+ (1) avec log K21= (0,8+0,76)*0,03 = 52 Zn2+ +4CN- <==> Zn(CN)42- (5) avec log K5= 16,7 2Ag+ +4CN- <==> 2Ag(CN)2-(4) avec log K4= 4 log b=42,2 -(4)+ (5) - (2)+(1) : 2Ag(CN)2- + Zn <=>2Ag + Zn(CN)42-. log K6=-42,2+16,7+52=26,5. réaction totale, récupération de l'argent solide. Zn+2H+ --> Zn2+ + H2. argent non attaqué par l'acide sulfurique 3Ag + NO3- +4H+ --> 3Ag+ + NO + 2H2O séparation par dissolution successive du zinc puis de l'argent
|
||||||||||||||||||||||
|