|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
préparation du nickel |
On étudie les réactions : 2C + O2 --> 2 CO (1) et 2 Ni + O2 --> 2 NiO (2)
corrigé |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
DH01=2 DH0(CO)-2 DH0(C)-DH0(O2)= -221 kJ mol-1. DH02=2 DH0(NiO)-2 DH0(Ni)-DH0(O2)= -488,6 kJ mol-1. DS01=2 S0(CO)-2 S0(C)-S0(O2)= 178,8 J mol-1. DS02=2 S0(NiO)-2 S0(Ni)-S0(O2)= -188,8 J mol-1. DG0=DH0-TDS0 DG01 = -221 000 -178,8 T DG02= -488 600 + 188,8 T 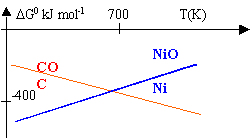
En égalisant ces 2 dernières expressions on trouve l'intersection des droites à T=728 K. Il est donc possible de réduire NiO par le carbone au dessus de cette température, en vue de préparer le nickel. NiO + C --> Ni + CO A 1000 K, DG0=DG01 - DG02 = -105 J mol-1. DG0 =-RT lnK donc K=2,3 105, réaction totale
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
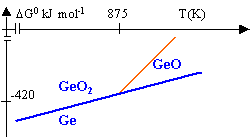
dismutation de GeO |
On étudie les réactions : 2Ge + O2 --> 2 GeO (1) et 2 GeO + O2 --> 2 GeO2 (2)
corrigé |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
DH01=2 DH0(GeO)-2 DH0(Ge)-DH0(O2)= -510 kJ mol-1. DH02=2 DH0(GeO2)-2 DH0(GeO)-DH0(O2)= -594 kJ mol-1. DS01=2 S0(GeO)-2 S0(Ge)-S0(O2)= -101 J mol-1. DS02=2 S0(GeO2)-2 S0(GeO)-S0(O2)= -197 J mol-1. DG0=DH0-TDS0 DG01 = -510 000 +101 T DG02= -594 000 + 197 T
2 GeO --> GeO2 + Ge (3) DH03= DH0(GeO2)+ DH0(Ge)-2DH0(GeO)= -42 kJ mol-1. DS03= S0(GeO2)-2 S0(GeO)+S0(Ge)= -48 J mol-1. DG03 = -42 000 + 48 T DG03 est
négatif tant que T< 875 K. La constante de la
réaction est supérieure à 1 et la
dismutation se produit à une température
inférieure à 875 K.
DH04= DH0(GeO2)- DH0(Ge)-DH0(O2 )= -552 kJ mol-1. DS04= S0(GeO2)- S0(O2)-S0(Ge)= -149 J mol-1. DG04 = -552 000 + 149 T point triple ( coexistence des 3 espèces) : 875 K et DG0 = -464 kJ Avant 875 K la réaction (4 )a lieu; au dela les
réactions (1) et (2) ont lieu . à 800 K l'oxydation donne GeO2; à 950 K l'oxydation donne GeO et GeO2.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
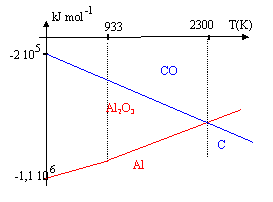
La poudre d'aluminium brûle très facilement ; la réaction est exothermique.
corrigé 4/3 Al + O2 = 2/3 Al2O3.(1) sur l'intervalle [250 K, 933 K] : DH01= 2/3 DH0(Al2O3)- 4/3DH0(Al)-DH0(O2 )= -1116 kJ mol-1. DS01= 2/3S0(Al2O3)- S0(O2)-4/3S0(Al)= 34-205-37,3 = -208,3 J K-1 mol-1. DG01 = -1 116 000 + 208,3 T. sur l'intervalle [933 K, 2500 K] DH01= 2/3 DH0(Al2O3)- 4/3[DH0(Al)+ Dfusion H°(Al)]-DH0(O2 ) DH01= -1116 -4/3* 10,9 = -1130,5 kJ mol-1. entropie de changement d'état à 933 K : S= Dfusion H°(Al) / Tfusion = -10900 / 933= 11,7 J K-1 mol-1. DS01= 2/3S0(Al2O3)- S0(O2)-4/3[S0(Al)+11,7]= 34-205-53 = -224 J K-1 mol-1. DG01 = -1 130 500 + 224 T. 2C+O2 = 2CO (2) DH02=2 DH0(CO)-2 DH0(C)-DH0(O2)= -220 kJ mol-1. DS02=2 S0(CO)-2 S0(C)-S0(O2)= 177 JK-1 mol-1. DG0=DH0-T DS0 DG02= -220 000 - 177 T Le cabone peut réduire l'alumine si l'enthalpie libre de la réaction suivante est négative : 3C+ Al2O3 = CO + 2Al obtenue à partir de 1,5 *(2) -1,5 (1) DG0= 1,5(DG02 - DG01) pour trouver la température à partir de laquelle cette réduction est possible , écrire que DG0 =0 soit DG02= DG01; -1 130 500 + 224 T= -220 000 -177 T T= 910500/ 401 = 2270 K. température trop élevée pour que cette méthode soit bon marché ; la préparation de l'aluminium se fait par électrolyse.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
A diverses températures T, on relève les valeurs correspondantes des enthalpies libres standard DrG0 (DrHG0 et DrSG0 seront considérées indépendantes de T ) relatives aux réactions d'obtention des oxydes de cuivre (I) et (II) : Cu2O (réaction 1) et CuO (réaction 2). ( les réactions ne font intervenir qu'une mole de dioxygène ).
corrigé Quand la température augmente de T=500 K, DrG01 augmente de 70 kJ/mol : DrG01 = 70/500 T + constante = 0,14 T + constante constante = -230 -0,14*800 = -230 -112 = - 342 kJ/mol DrG01 = 0,14 T -342. Quand la température augmente de T=500 K, DrG02 augmente de 90 kJ/mol : DrG02 = 90/500 T + constante = 0,18 T + constante constante = -170 -0,18*800 = -170 -1442 = - 314 kJ/mol DrG02 = 0,18 T -314. le signe positif des pentes des droites obtenues indique des réactions endothermiques. valeurs respectives de DrH ° et DrS° pour les réactions (1) et (2). DrG0 = DrH ° -TDrS0 par identification : DrH0 1 = -342 kJ/mol ; DrS0 1 = 0,14 kJ K-1 mol-1. par identification : DrH0 2 = -314 kJ/mol ; DrS0 2 = 0,18 kJ K-1 mol-1. 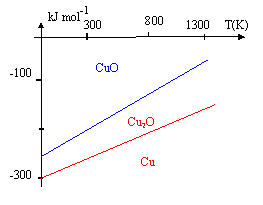
4Cu+O2 =2 Cu2O (1) 2 Cu + O2 = 2 CuO (2) ½ (2)- ½ (1) donne : Cu2O = Cu + CuO (3) DrG03 =½(DrG02 -DrG01 )= 0,18T-314 -(0,14 T-342) DrG03 = 0,04 T +28 . L'étude thermodynamique de l'oxydation du cuivre montre que la coexistence, à l'équilibre, entre le cuivre et l'oxyde de cuivre (II) est impossible. L'oxyde en contact avec le métal est Cu2O. Ce dernier peut être oxydé à son tour en CuO par le dioxygène. D'un point de vue cinétique, l'oxydation du cuivre par O2 sec en CuO via Cu2O est très lente. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Réduction de la chromite: La chromite est oxydée, en milieu alcalin, en chromate de potassium et oxyde ferrique. Le chromate de potassium est séparé par dissolution dans l’eau puis précipité sous forme de dichromate de potassium qui est réduit par le carbone en oxyde de chrome (III) Cr2O3 qu’il s’agit de réduire en chrome métallique.
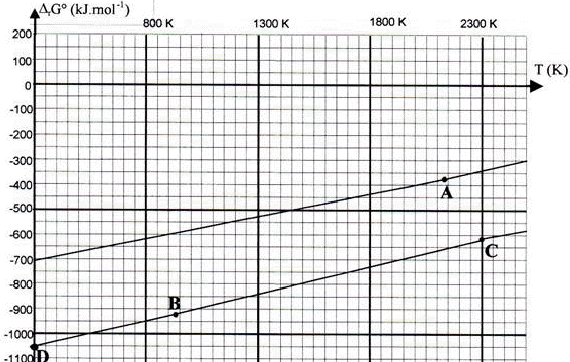 Ce diagramme représente l’enthalpie libre
standard de formation des oxydes pour une mole de
dioxygène en fonction de la température.
corrigé Cr2O3 (s)+ 3H2 (g)= 2 Cr (s)+ 3H2O(g) D H= 3 DfH° (H2O) - DfH° (Cr2O3) = -3* 242 +1140 = 414 kJ mol-1. D S = 3 S° (H2O) + 2S°(Cr)- S° (Cr2O3)-3S°(H2)= 3*189 + 2*24-3*131-81 = 141 J K-1 mol-1. D G= D H-T D S = 414000-1300*141 = 230700 J mol-1. DG positif; donc réaction endothermique favorisée par une élévation de température. ln K= - D G / ( RT) = -230700 / (8,31*1300) = -21,35 K= 5,3 10-10 donc réaction spontanée en sens inverse ( de droite à gauche). 4/3 Al + O2 = 2/3 Al2O3 4/3 Cr + O2 = 2/3 Cr2O3 Al , le plus réducteur, est situé en dessous de la droite CD la droite du bas correspond à Al2O3 / Al. A : fusion du chrome à 2130 K B : fusion aluminium à 933 K C : fusion alumine. pente du segment DB : - DS de la réaction 4/3 Al + O2 = 2/3 Al2O3 D S = 2/3S( Al2O3 )- 4/3S( Al)-S(O2) = 2/3*51-4/3*28-205=34-37,3-205= -208,3 J K-1 mol-1 - DS = 208,3 J K-1 mol-1 . pente du segment BC : entropie de changement d'état à 933 K : S= Dfusion H°(Al) / Tfusion = -11000 / 933= 11,8 J K-1 mol-1. DS0= 2/3S0(Al2O3)- S0(O2)-4/3[S0(Al)+11,8]= 34-205-53 = -224 J K-1 mol-1. - DS = 224 J K-1 mol-1 . Cr2O3 (s)+ 2Al(l) = 2Cr (s)+ Al2O3(s) D H = D (Al2O3)-DH ( Cr2O3) - 2Dfusion H°(Al)= -1676+1140-22 = -558 kJ mol-1 D S = S( Al2O3 ) + 2 S (Cr) - S( Cr2O3 )-2[ S( Al)+ Dfusion H°(Al) / Tfusion] D S = 51+2*24-81-2(28 +11,8)= -61,6 J K-1 mol-1 D G= D H-T D S = -558000 + 61,6*1300 = -477900 J mol-1 ln K = 477900 / (8,31*1300) = 44.3 K= 1,7 10 24 K est très grand, donc réaction spontanée, totale dans le sens direct. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|