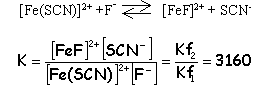|
|
|
|
édifice polyatomique dans lequel on
distingue un atome ou cation central lié
à des molécules ou des ions
appelés
ligands chélate complexe cyclique entre
une entité centrale et un
ligand
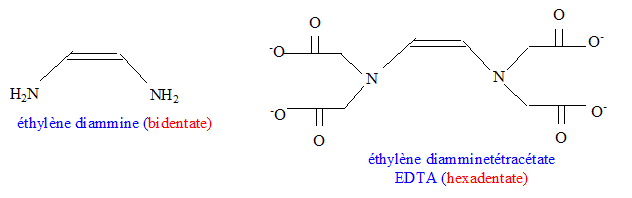
multidenté (
peut former plusieurs liaisons avec l'atome
central) nombre
de coordination : nombre de ligands liés à
l'entité centrale;
dépend de l'entité centrale et du
ligand. Dans
le nom du complexe, l'anion est nommé en
premier puis le cation Le(s)
nom(s) du(des)des ligand(s)
précède(nt) celui de l'atome
métallique central (c'est l'inverse dans
l'écriture de la formule) Le
nom d'un ligand négatif se termine souvent
par "o" : chloro
Cl- ; cyano
CN-, hydroxo
HO-, sulfato
SO42-. Quelques noms
particuliers : aqua
H2O, ammine
NH3, carbonyl
CO Le
préfixes mono, di, tri, tetra, penta, hexa
indique le nombre de chaque ligand Ni(PPh3)2Cl2
:
dichlorobis(triphenylphosphine)nickel(II). Un
chiffre Romain ou un zéro écrit entre
parenthèses indique le nombre d'oxydation de
l'atome métallique central. Si
l'ion complexe est négatif, le nom du
métal finit en 'ate' : ferrate,
cuprate. Les
ligands sont nommés par ordre
alphabétique quel que soit leur
nombre. [Fe(H2O)5OH]2+
......ion
pentaaquahydroxofer
(III) [Cr(SCN)4(NH3)2]-
......ion
tétrathiocyanatodiamminechromate
(III) [Fe(CO)5]
.....
pentacarbonylefer
(0) [CrCl2(H2O)4]+
ion dichlorotétraaquachrome
(III)
complexe
de coordination :
Nomenclature
: les règles
|
|
|
|
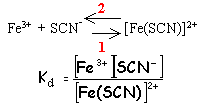
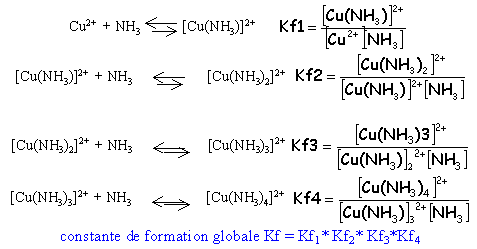
sens 2 : dissociation ; sens1 : formation ; Kd constante de dissociation |
constante de formation Kf= 1/ Kd plus un complexe est stable plus Kf est grand |
|
complexes successifs L'addition d'ammoniac à une solution aqueuse d'ion Cu2+ se traduit par le remplacement progressif des molécules d'eau par celle d'ammoniac.
|
|
[Ag(NH3)]+ pKd1=3,2 ; [Ag(NH3)2]+ pKd2=3,83
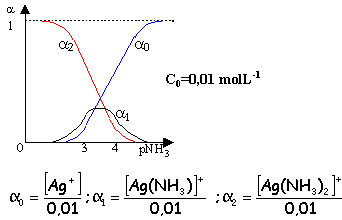
le complexe de coordination le plus élevé est majoritaire si pNH3< 2 ou [NH3]< 0,01 molL-1.
Ce diagramme donne les % des différentes entités en fonction de [NH3] libre.
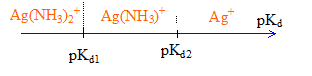
Le complexe de constante de formation Kf la plus élevée, déplace les autres complexes
|
|
|
|
|
|
|
|
|
Kf1= 100= Fe(SCN)2+ / ([Fe3+][SCN-]) (1) initialement [Fe3+] =10-3 ; [SCN-]=0,1 molL-1 grand excès pratiquement tous les ions
Fe3+ sont complexés
[SCN-]= 0,1-10-3=9,9 10-2 molL-1 . d'après(1)
[Fe3+]
=
10-4 molL-1
.
approximation
valable
Fe(SCN)2+ = 3 10-6 molL-1 d'où [F-] libre= 10-2 molL-1 d'où [F-] total= [F-] libre+ [FeF]2+ = 1,1 10-2 molL-1 soit 1,1 10-4 mol de NaF dans 10 mL |
|
|
|
|
|
|
|
|
|
|
bilan de l'argent : [Ag(NH3)2]+ + [Ag(NH3)]++[Ag+] = 0,05 d'où [Ag(NH3)]+= 0,0142 molL-1. Kd=[Ag+] [NH3] / [Ag(NH3)]+= 3,17 10-4 . deux réactions sont susceptibles de se produire NH4+ + H2O équilibre NH3 + H3O+ Ka=10-9,2. NH4+ +Ag+ + H2O équilibre Ag(NH3) + + H3O+ K'a= 10-9,2 / 3,17 10-4= 2 10-6. pK'a= 5,7 Bilan des ions hydronium formés dans ces deux réactions [H3O+] = [NH3] +[Ag(NH3)]+ [H3O+] =10-9,2[NH4+ ] /[H3O+] + 2 10-6[NH4+ ] [Ag+]/ [H3O+] d'où [H3O+] =7,2 10-5 molL-1. pH=4,14 |
|