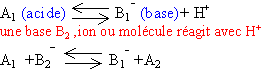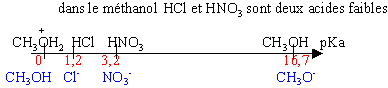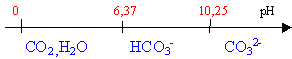|
|
|
|
|
|
|
|
|
|
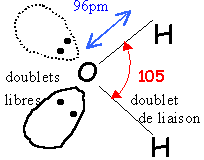
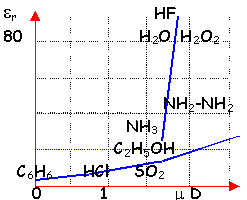
moment dipolaire m=1,84 D
de la polarisation de la liaison O-H (différence d'électronégativité des atomes liés) présence de 2 doublets non liants
liaisons hydrogène dans le liquide et le solide
De nature électrostatique ,
elle s'établit entre un atome d'hydrogène
porteur d'une charge partielle d+
et l'atome d'oxygène d'une molécule d'eau
voisine. Energie de cette liaison :20
kJmol-1, trés inférieure
à l'énergie d'une liaison de covalence (100
à 400). Les ions proviennent d'une
rupture d'une liaison O-H. Il y a formation d'un
ion hydroxyde OH- et d'un ion hydronium
H3O+.
le proton libre
H+ n'existe pas en
solution . De diamètre voisin de
10-15 m, porteur d'une charge 1,6
10-19 C , il crée dans son
voisinage un champ électrique intense qui
attire à lui les molécules
d'eau. produit
ionique de l'eau Ke=[
H3O+][OH-]=
10-14 à 25°C Ke croît avec la
température
|
|
|
|
les solutions aqueuses
|
La dissolution d'un cristal ionique est le résultat de 2 phénomènes :
mise en solution de composés ionisables : solvolyse il s'agit de véritables réactions chimiques avec formation d'ions hydratés. HCl gaz + H2O ----> H3O+ + Cl-. NH3 +
H2O en équilibre avec
NH4+ + OH-
Un soluté porteur de groupement -OH alcools oses sera soluble dans l'eau formation de liaisons hydrogène avec l'eau. |
|
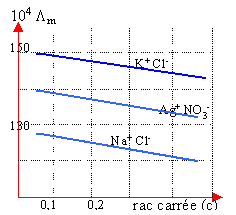
Un ion est soumis à la force électrique qE et à une force de frottement opposée, proportionnelle à la vitesse et au rayon de l'ion. Les ions atteignent rapidement une vitesse limite. La vitesse limite est proportionnelle au champ E. Le coef de proportionalité est appelé mobilité de l'ion notée u+ ou u-. |
dissolution d'un sel MnXn à la concentration c molL-1. MnXn --->n Mn+ +n Xn-. conductivité : g =n²cF(u+ + u-) conductivité molaire Lm =g / c g :en S m-1 ; Lm : en S m²mol-1 ; F :faraday ; |
|
 |
|
 |
|
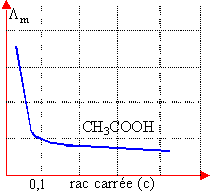
Dans les solutions réelles, il faut tenir compte des interactions électrostatiques entre ions. |
activité = coef moyen d'activité fois
concentration
|
|
force ionique de la solution I c concentration molaire de l'ion de charge z |
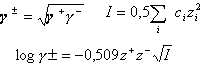
|
pH d'une solution d'acide chlorhydrique à 0,1 molL-1.
force ionique I=0,5(0,1*1²+0,1*1²)= 0,1 molL-1.
coef d'activité moyen =inv log(-0,509*1*1*rac carrée(0,1))=0,69
activité des ions : 0,69*0,1=6,9 10-2molL-1.
pH de la solution : -log(6,9 10-2)=1,16.
acide et base : transfert de proton
|
Un acide est un ion ou molécule capable de céder un proton. Une base est un ion ou molécule capable de gagner un proton. acide et base sont liés par l'équilibre :
|
NH4+ / NH3 H3O+ /H2O H2O / OH- H3CCO2H / H3CCO2- ampholyte ou amphotère : espèces pouvant jouer le rôle d'acide ou de base
|
|
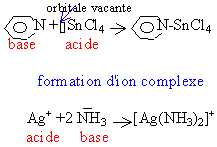
Une base est un ion ou molécule qui peut donner un doublet électronique. Un acide est un ion ou molécule disposant d'une orbitale vacante. le résultat est la formation d'une liaison de covalence |
|
|
forces des acides et des bases dans l'eau l'acide le plus fort qui puisse exister dans l'eau est H3O+ et la base la plus forte est OH-. |
|
|
la mise en solution correspond à une réaction totale. Les ions Na+, K+, Cl- sont indifférents |
la mise en solution correspond à une réaction partielle conduisant à un équilibre chimique |
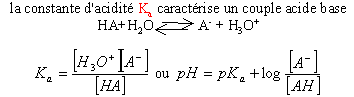 pKa=-log(Ka) pKa=-log(Ka)
dans l'eau
l'échelle des pKa est limitée entre 0
et 14
|
|
|
En partant de deux solutions de même concentration :
Dans l'eau tous les acides forts ont le même pka (0) ; toutes les bases fortes ont le même pKa (14): On ne peut comparer leur forces dans ce solvant. On utilise donc d'autres solvants.
|
|
pH des solutions aqueuses
|
écrire les réactions chimiques se produisant lors de la mise en solution. ajouter la réaction d'autoprotolyse de l'eau définir les constantes relatives aux réactions précédentes électroneutralité de la solution conservation de la matière d'un élément faire les approximations
justifiées que l'on vérifiera
à la fin
|
|||||||||
|
pH= -log(c) valable si pH< 6,5 |
pH= 14+ log(c) valable si pH> 7,5 |
||||||||
|
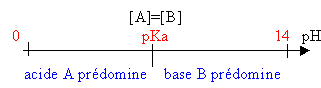
pH=pKa+log([B] / [A]) |
|
||||||||
|
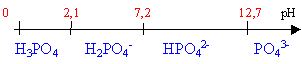
polyacide faible pH d'une solution 10-3 mol L-1 d'acide phosphorique pKa1=2,1; pKa2=7,2; pKa3=12,7. 7,94
10-3=[H2PO4-][H3O+]/[H3PO4] 10-3=
[H3O+]+
[H3O+]²/7,94
10-3 [H2PO4-]=[H3O+] [H2PO4-]=8,9
10-4molL-1 10-3=[H2PO4-]+[H3PO4] |
|||||||||
|
polybase faible pH d'une solution 10-2 mol L-1 de carbonate de potassium pKa1=6,37; pKa2=10,25; 5,62
10-11=[CO32-][H3O+]/[HCO3-] autoprotolyse de
l'eau [H3O+][OH-]=10-14
à 25 °C 5,62 10-25 =
-10-14[H3O+]+
0,01[H3O+]² [OH-]+[HCO3-]
+2[CO32-]=[K+]=0,02 [HCO3-]
=[OH-]=1,25
10-3molL-1 [HCO3-]
+[CO32-]=0,01 |
|||||||||
mélange d'acide - mélange de base
|
pH= -log(c1+c2) valable si pH< 6,5 On mélange 50 mL sol HCl à 0,01 molL-1 à 25 mL d'une solution d'acide perchlorique à 0,02 mol L-1. [H3O+]=[Cl-]+[ClO4-] milieu acide 0,01*50/75 + 0,02*25/75 =0,0133 molL-1 pH= 1,9 |
pH=14+log(c1+c2) valable si pH> 7,5 On dissout dans 0,1 L d'eau 2,1 g d'hydroxyde de sodium et 0,83 g de Na2O. Les 2 réactions sont totales et donnent des ions sodium et hydroxyde. Na=23 ; O=16 ; H=1 gmol-1. [Na+]=[OH-] milieu basique [Na+]=(2,1/40+0,83/62)/0,1 0,793 molL-1. pH=13,9 |
|
|
|
mélange d'un acide fort et d'un acide faible
|
|
|
|
solution électriquement neutre [A-] +[Cl-]=[H3O+] ---> [A-]=[H3O+]-0,01 |
[H3O+]² -8,59 10-3 [H3O+] -1,55 10-4=0 |
|
[AH]+[A-]=0,1 --->[AH]= 0,1-[A-]=0,11-[H3O+] |
pH=1,8 |
|
1,41 10-3=[A-][H3O+]/[AH] 1,41 10-3 (0,11-[H3O+] )=([H3O+]-0,01)[H3O+] |
|
mélange de 2 acides faibles
|
|
|
|
1,819 10-4=[A1-][H3O+]/[HA1] 1,819 10-5=[A2-][H3O+]/[HA2] |
[A2-]=1,819 10-5*6,66 10-3/[H3O+] |
|
[HA1] +[A1-]=0,1 *25/75= 3,33 10-2. [HA2] +[A2-]=0,01 *50/75= 6,66 10-3. |
|
|
solution électriquement neutre [A1-] +[A2-]=[H3O+] |
[H3O+]² =6,181 10-6. |
|
[HA1] voisin 3,33 10-2 [HA2] voisin 6,66 10-3 |
pH=2,6 inférieur à pKa-1 les approximations sont légitimes |
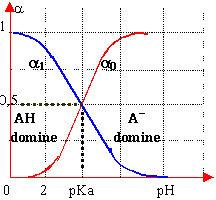
diagrammes
|
|
|
|
a0+a1=1 |
 |
|
diagramme logarithmique des concentrations détermination graphique du pH |
|
|
On peut négliger [A-] devant [HA] si [A-]< 10*[HA] (pH< pKa-1) --->[HA]=C en conséquence
:log[A-]=log
C + pH-pKa
ces relations proviennent de la définition de la constante d'acidité Ka |
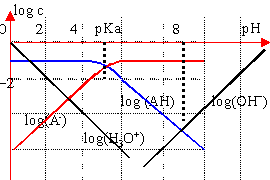
la solution est électriquement neutre : [H3O+]= [A-] ion hydroxyde minoritaire pH cherché : intersection des courbes log [A-] et log[H3O+] |
solution tampon
|
Le pH de la solution est voisin du pKa et varie peu :
|
|
|
il mesure la variation de pH lors de l'addition d'une quantité dC molL-1 d'acide fort ou de base forte. Le pouvoir tampon d'une solution contenant un acide faible HA (concentration Ca) et sa base faible conjuguée A- (concentration Cb) est proportionnel à la concentration totale et passe par un maximumn si Ca=Cb. |
retour - menu