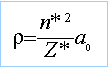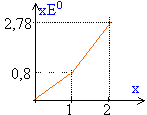|
d'après agrégation interne 99
|
||||||
|
||||||
|
atome d'argent |
L'argent (Z=47) existe sous 2 formes isotopiques. 107Ag(51,83%) de masse 106,90 uma et 109Ag (48,17%) de masse 108,90 uma.
corrigé |
|||||
|
rayon
|
Z=47 donc 47 protons dans le noyau et 47 électrons dans l'atome A=107 donc 107-47 =60 neutrons pour l'autre isotope, seul le nombre de neutrons varie : 109-47 = 62 neutrons masse molaire : (0,5183 *106,9 +0,4817*108,9) = 107,86 uma 107,86*1,661 10-27 *6,022 1023 =0,1078 kg = 107,8 g mol-1. règle de remplissage des niveaux électroniques : Klechlowsky: n + l croissant si n + l égaux dans l'ordre croissant des valeurs de n ordre prévu :1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d9 5s2 en réalité : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 5s1 l'orbitale 4 d saturée stabilise l'atome
règles de Slater :
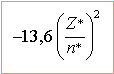
E=Ecoeur + énergie des électrons 4d et 5s hypothèse :orbitales 4d10 5s1. Z*=Z-écran sur l'électron 5s : 47-(18*0,85 + 28)= 3,7 énergie de cet électron :-13,6*Z² / 4²= -13,6*3,7²/16 = -11,64 eV Z* = Z- écran sur un électron 4d = 47-(9*0,35+36) =7,85 énergie d'un électron 4d: -13,6*7,85² / 3,7² = -61,21 eV E2=E=Ecoeur -10*61,21-11,64 = Ecoeur -623,74 eV hypothèse :orbitales 4d9 5s2. Z*=Z-écran sur l'électron 5s : 47-(0,35+17*0,85 + 28)= 4,2 énergie de cet électron :-13,6*Z² / 4²= -13,6*4,2²/16 = -15 eV Z* = Z- écran sur un électron 4d = 47-(8*0,35+36) =8,2 énergie d'un électron 4d: -13,6*8,2² / 3,7² = -66,8 eV E1=E=Ecoeur -9*66,8-2*15 = Ecoeur -631,2 eV E1 <E2 anomalie, les règles de Slater ne sont pas assez précises dans ce cas. rayon atomique pour la configuration réelle : 52,9 *4²/ 3,7 = 229 pm
|
|||||
|
les ions Ag+ et Ag2+. Frost |
corrigé |
|||||
|
énergie d'ionisation = - énergie de l'électron 5s Z*=Z-écran sur l'électron 5s : 47-(18*0,85 + 28)= 3,7 énergie de cet électron :-13,6*Z² / 4²= -13,6*3,7²/16 = -11,64 eV énergie d'ionisation : 11,64 eV. DG0 = -nFE0. 2Ag+ +2e- équilibre avec 2Ag (1) DG01 = -2*0,8 F Ag2+ +2e- équilibre avec 2Ag (2) DG02 = -2*1,39 F (2) -(1) Ag2+ + Ag équilibre avec 2Ag+ DG0 =(-2,78+1,6) F DG0 négatif donc stabilité de Ag+.
|
||||||
|