|
|
|||||||||||||
|
|||||||||||||
|
solution CaCl2 |
Le chlorure de calcium proposé en ampoule de 10 mL contient 1 g de CaCl2, x H2O. On veut déterminer la valeur de x par conductimétrie. On dispose pour étalonner la cellule conductimétrique, d'une échelle de concentration en chlorure de calcium. Le tableau ci dessous donne la conductance de ces différentes solutions:
corrigé |
||||||||||||
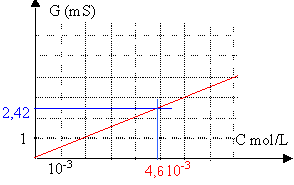
concentration de la solution diluée : 4,6 10-3 mol/L d'après le graphe. concentration de la solution mére : (facteur de dilution =100) 100*4,6 10-3 = 0,46 mol/L donc : 0,46 * 0,01 = 4,6 10 -3 mol dans 10 mL d'une ampoule masse molaire CaCl2 , x H2O: 40 + 2*35,5 +18 x= 111+18 x g/mol masse (g) / masse molaire = 1 / (111+18x) = 4,6 10-3 mol 111+18 x = 1 / 4,6 10-3 = 217 18 x = 217-111 d'où x voisin de 6 CaCl2, 6H2O
|
|||||||||||||
|
calcul de conductance |
On a déterminé avec le même montage, à la même température, la conductance contenant respectivement 4 mmol/L de chlorure de sodium, de chlorure de potassium, de nitrate de potassium: G(Na+ + Cl- )= 1,16 mS ;G(K+ + Cl- )= 1,37 mS ; G(K+ + NO3- )= 1,33 mS .
corrigé |
||||||||||||
|
1,37 = 4 10-3 [lK+ + l Cl-] (2). 1,33 = 4 10-3 [lK+ + l NO3-] (3). (3) + (1)- (2) donne : 1,12 = 4 10-3 [lNa+ + l NO3-] La solution la plus conductrice possède la plus grande conductance: solution de chlorure de potassium |
|||||||||||||
|
solution Ca(NO3)2 |
données : à 25°C corrigé |
||||||||||||
|
masse molaire : 40 + 2*(14+3*16)= 164 g/mol concentration des ions Ca2+ : 1,5 /164 = 9,15 10-3 mol/L concentration des ions nitrate : 2* 9,15 10-3 = 1,83 10-2 mol /L conductivité de la solution : s = 9,15 10-3 lCa2+ +1,83 10-2lNO3- s = 9,15 10-3 *11,9 +1,83 10-2 *7,14 = 0,234 mS/m
|
|||||||||||||
|
solubilité du fluorure de calcium |
données à 18 °C : lCa2+ = 10,50 mS m² mol-1 ; lF- = 4,04 mS m² mol-1 ;
corrigé |
||||||||||||
|
la solution reste électriquement neutre ; j'en déduis : [F-] = 2 [Ca2+] conductivité de la solution : 3,71 = [Ca2+]*10,5 + [F-] * 4,04 3,71 = [Ca2+]*10,5 + 2 [Ca2+] * 4,04 [Ca2+] = 3,71 / ( 10,5+2*4,04 )= 0,2 mol /m3. et [F-] = 0,4 mol /m3. |
|||||||||||||
|
dosage d'un détartrant |
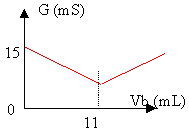
On veut déterminer la concentration en acide chlorhydrique d'un détartrant. Pour cela on dilue 200 fois ce détartrant. On prélève V= 100 mL de la solution diluée S obtenue, on ajoute tout en agitant une solution d'hydroxyde de sodium de concentration 0,096 mol/L. On mesure la conductance de la solution et on obtient le graphe ci-dessous.
corrigé |
||||||||||||
|
le facteur de dilution est de 200 . prélever à la pipette jaugée 5 mL de détartrant placer dans une fiole jaugée de 1L ( 1000 / 200 = 5 mL) compléter avec de l'eau distilée équation de dosage : H3O+ + HO- donne 2 H2O réaction acide base. le volume équivalent est déterminer par l'intersection des deux droites soit 11 mL. Avant l'équivalence, les ions oxonium réagissent avec les ions hydroxyde. Des ions sodium sont apportés par la soude. Or la conductivité molaire ionique des ions oxonium est bien plus grande que celle des ions sodium: en conséquence la conductivité de la solution diminue. après l'équivalence on ajoute à la solution des ions sodium et hydroxyde: en conséquence la conductivité de la solution va coître à nouveau. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoéchiométriques. Quantité de matière de soude : 0,096 *11 = 1,056 mmol quantité de matière d'ion oxonium : 100 C mmol 100C=1,056 d'où C= 1,056 10-2 mol/L le facteur de dilution est égal à 200 : la concentration de l'acide chlorhydrique dans la solution de détartrant est donc 2,1 mol/L
|
|||||||||||||
|
|
|||||||||||||