|
L'acide salycilique est utilisé dans la
synthèse de l'aspirine ; l'acide benzoïque est un conservateur
alimentaire.
A étude de la fonction acide :
On se propose à partir de mesures conductimétriques de
comparer les acidités de l'acide salicylique et de l'acide benzoïque.
- Etude théorique : On dispose d'un volume V d'une
solution aqueuse d'un acide HA de concentration c. La transformation
mettant en jeu la réaction de l'acide HA avec l'eau n'est pas totale.
- Ecrire l'équation de la réaction de HA avec l'eau.
- Dresser le tableau d'avancement du système. Exprimer les
concentrations des espèces présentes à l'équilibre en fonction de c et
de la concentration en ion oxonium [H3O+]éq.
En déduire l'expression du quotient de réaction Qr,éq en
fonction de [H3O+]éq. et c.
- L'étude de la solution à l'équilibre est effectuée par
conductimétrie. Exprimer la conductivité s
de la solution HA à l'équilibre en fonction de [H3O+]éq
et des conductivités molaires ioniques l
des ions présents.
- Etude exprérimentale : conductivités molaires
ioniques à 25°C en S m² mol-1.
l1= l
( ion oxonium) = 35 10-3 ; l2= l (ion
salicylate)= 3,62 10-3.
pKa (acide salicylique / ion salicylate) = 3 ; pKa( acide benzoïque/
ion benzoate) = 4,2.
- On dispose du matériel suivant : bechers de 50, 10 et 250 mL ;
éprouvettes graduées de 10, 20, 50 et 100 mL ; fioles jaugées de 50,
100 et 250 mL; pipettes graduées de 10 mL à + ou - 0,1 mL; pipette
jaugée de 10 mL à + ou - 0,05 mL; pipeteur.
On veut préparer une solution S de l'acide HA de concentration c= 10-3
mol/L à partir d'une solution mère S0 de concentration 10-2
mol/L. Comment procède t-on ? Nommer la verrerie utilisée.
- Mesures de conductivité : on a effectué un ensemble
de mesures de conductivité s pour des
solutions d'acide salicylique et d'acide benzoïque de diverses
concentrations à 25°C.
|
c(mol/L)
|
s (Sm-1)
|
[H3O+]éq mol/L
|
Qr,éq
|
-logQr,éq
|
|
ac. salicylique
|
10-3
|
2,36 10-2
|
6,11 10-4
|
9,6 10-4
|
3,01
|
|
ac. salicylique
|
5 10-3
|
7,18 10-2
|
|
|
|
|
ac. salicylique
|
10 10-3
|
10,12 10-2
|
2,62 10-3
|
9,3 10-4
|
3,03
|
|
ac. benzoïque
|
10-3
|
0,86 10-2
|
2,25 10-4
|
6,53 10-5
|
4,19
|
|
ac. benzoïque
|
5 10-3
|
2,03 10-2
|
5,31 10-4
|
6,31 10-5
|
4,2
|
|
ac. benzoïque
|
10 10-3
|
2,86 10-2
|
7,47 10-4
|
6,03 10-5
|
4,22
|
- Compléter le tableau. Présenter les calculs sous forme littérale
avant d'effectuer les applications numériques.
- A partir de valeurs de [H3O+]éq
comparer le comportement à concentration égale de l'acide salicylique
et de l'acide benzoïque en solution dans l'eau.
- Donner la définition de la constante d'acidité Ka. Expliquer comment
les résultats de cette étude expérimentale permettent de retrouver les
valeurs respectives des pKa des deux acides.
B Synthèse de l'aspirine :
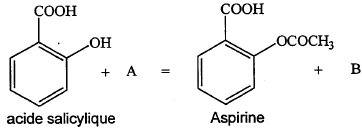
- Entourer et nommer les fonctions chimiques présentes dans
la formule de l'aspirine.
- Le groupement OH de l'acide salicylique se comporte comme
une fonction alcool dans la transformation étudiée.
- Donner les formules semi-développées et les noms des espèces
chimiques A et B sachant qu'ils ne contiennent pas d'autres éléments
que C, H et O.
- Nommer cette réaction chimique et citer deux de ses caractéristiques.
corrigé
HA + H2O = A- + H3O+
|
HA
|
A-
|
+ H3O+
|
|
initial
|
c V
|
0
|
0
|
|
en cours
|
c V-x
|
x
|
x
|
|
équilibre
|
c V-xéq
|
xéq
|
xéq
|
[HA]éq=(c V-xéq) / V ; [A-
]éq=[H3O+]éq=xéq
/V;
[HA]éq= c -[H3O+]éq
;
Qr,éq= [A- ]éq*[H3O+]éq
/ [HA]éq= [H3O+]2éq
/ (c -[H3O+]éq ) ;
s = l1[H3O+]éq
+ l2 [A- ]éq
= (l1 + l2 )[H3O+]éq
;
facteur de dilution = [solution mère] /
[solution fille]= 10
le volume de la pipette doit être 10 fois plus petit que le
volume de la fiole jaugée.
prélever 10 mL de la solution mère à l'aide de la pipette
jaugée de 10 mL
placer dans une fiole jaugée de 100 mL
compléter jusqu'au trait de jauge à l'aide d'eau distillée.
|
c(mol/L)
|
s (Sm-1)
|
[H3O+]éq mol/L
|
Qr,éq
|
-logQr,éq
|
|
ac. salicylique
|
10-3
|
2,36 10-2
|
6,11 10-4
|
9,6 10-4
|
3,01
|
|
ac. salicylique
|
5 10-3
|
7,18 10-2
|
1,86 10-3
|
1,1 10-3
|
2,96
|
|
ac. salicylique
|
10 10-3
|
10,12 10-2
|
2,62 10-3
|
9,3 10-4
|
3,03
|
|
ac. benzoïque
|
10-3
|
0,86 10-2
|
2,25 10-4
|
6,53 10-5
|
4,19
|
|
ac. benzoïque
|
5 10-3
|
2,03 10-2
|
5,31 10-4
|
6,31 10-5
|
4,2
|
|
ac. benzoïque
|
10 10-3
|
2,86 10-2
|
7,47 10-4
|
6,03 10-5
|
4,22
|
[H3O+]éq = s
/(l1
+ l2 ) = s /((35+3,62)10-3)=1000 s /38,62 = 25,9 s = 25,9*7,18 10-2
=1,86 mol m-3
[H3O+]éq = 1,86 10-3 mol/L
Qr,éq= [H3O+]2éq
/ (c -[H3O+]éq ) =(1,86 10-3)2 / (5 10-3
-1,86 10-3) = 3,46 10-3
/ 3,14 = 1,1 10-3.
à concentration égale l'acide salicylique est plus ionisé que
l'acide benzoïque.
le taux d'avancement final pour l'acide salicylique est
supérieur à celui de l'acide benzoïque.
l'acide salicylique, à concentration égale est plus fort que
l'acide benzoïque.
La constante d'acidité Ka est la constante de l'équilibre
suivant : HA + H2O = A- + H3O+
Ka =[H3O+]éq[A- ]éq
/[HA]éq = Qr,éq ;
on trouve ( 3 premières lignes du tableau) pKa voisin de 3
pour l'acide salicylique.
de même à partir des 3 dernières lignes on retouve le pKa de
l'acide benzoïque, voisin de 4,2.
-COOH :
fonction acide carboxylique
-OCO-CH3 :
fonction ester
A : anhydride éthanoïque CH3-CO-O-OC-CH3
; B : acide éthanoïque CH3-COOH
estérification : réaction rapide, exothermique et
totale en présence de l'anhydride éthanoïque.
Il ne se forme pas d'eau, l'ester ne peut pas être hydrolysé.
|

