|
3+4 points avec calculatrice |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
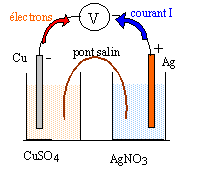
A partir des couples oxydant/réducteur Cu2+/Cu et Ag+/Ag on peut envisager deux transformations dont les réactions peuvent être schématisées par les équations suivantes : Cu+ 2Ag+= 2Ag+ Cu2+ (1) ; Cu2++ 2Ag= 2Ag++ Cu (2) Les constantes d'équilibres de ces réactions sont K1 = 2,1 1015 et K2 = 4,8 10-16. A / transformation chimique spontanée par transfert direct d'électrons : Un élève réalise l'expérience dont le protocole est donné
ci-dessous : - Plonger un fil d'argent et ajouter 3 g de poudre de cuivre
de couleur rouge. Agiter et filtrer la solution obtenue ; observer sa
couleur.
B / Constitution et fonctionnement de la pile cuivre argent en circuit fermé : On dispose : d'un fil de cuivre, d'un fil d'argent, d'une solution de sulfate de cuivre (II) de volume V1 = 50 mL et de concentration molaire c1 = 1 mol/L, d'une solution de nitrate d'argent de volume V2 = 50 mL et de concentration molaire c2 = 1 mol/L, d'un papier imbibé de nitrate de potassium pouvant constituer un pont salin.
On peut prévoir le sens d'évolution spontanée d'un système en comparant le quotient de réaction Qr et la constante d'équilibre K de la réaction envisagée : Qr =K, le système est en équilibre. Qr <K, le système évolue dans le sens direct. Qr >K, le système évolue dans le sens inverse Qr,i = [Cu2+]i / [Ag+]i2 =½C1 / (½C2)² = 0,5/0,252 = 8. K1 = 2,1 1015 ; Qr,i <K1
, évolution dans le sens direct, gauche vers la droite.
Cu--> Cu2+ + 2e- oxydation ( anode) Ag+ + e---> Ag réduction à la cathode Cu+ 2Ag+= 2Ag+ Cu2+ . Qr,i = [Cu2+]i / [Ag+]i2 = C1 / C2² = 1. K1 = 2,1 1015 ; Qr,i <K1 , évolution dans le sens direct, gauche vers la droite. [Cu2+] augmente au cours du temps ; [Ag+] diminue ; Qraumente et se rapproche de K La pile est un système hors équilibre.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Deux étudiants préparent 8 ampoules identiques. Ils
introduisent dans chaque ampoule 0,1 mol d'éthanol et 0,1 mol d'acide
éthanoïque. Les ampoules sont fermées hermétiquement et placées dans
une étuve à température constante ( 100°C) à une date initiale ( t=0).
Dans les questions qui suivent, on appelle n0 la quantité d’acide éthanoïque et la quantité
corrigé CH3-COOH + CH3-CH2OH = CH3-COO-CH2-CH3 + H2O ester : éthanoate d'éthyle refroidir réalise un blocage cinétique
taux avancement final dans chaque ampoule : avancement final (mol) / avancement maximal (mol) t = xf/ xm.
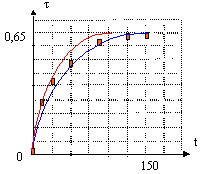
la courbe rouge correspond à une expérience réalisée à température plus élevée : l'équilibre est plus rapidement atteint, sans être modifié. La vitesse d'une réaction augmente avec la température. L'estérification est une réaction lente et limitée par l'hydrolyse de l'ester.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|