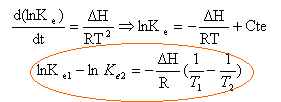|
|
||||||||
|
||||||||
|
corrigé |
||||||||
|
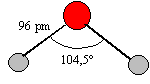
L'environnement électronique de l'atome d'oxygène est tétraèdrique déformé par deux doublets non liants deux
orbitales hybrides sp3 de l'oxygène sont
recouvertes par deux orbitales des deux atomes
d'hydrogène.
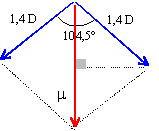
différence d'électronégativité entre les éléments O et H : 3,5-2,1 = 1,4 D(debye) moment dipolaire de la liaison OH : vecteur dirigé suivant la liaison O-H, de O vers H.
m=2*1,4 sin(90-52,25)=1,72 D. cette valeur est assez proche de la valeur réelle 1,85 D.
|
||||||||
|
l'eau solide :
l'eau liquide :
conductivité c d'un électrolyte est l'inverse de la résistivité : La conductivité équivalente L d'un électrolyte monovalent est, par définition, L=1000c / C où C est la concentration de l'électrolyte en mol/L. L tend vers une limite L0 lorsque C devient suffisamment faible: L0 est la conductivité équivalente limite de l'électrolyte.
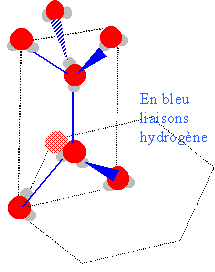
corrigé l'eau solide : réseau cristallin de la glace :
Chaque atome d'oxygène est entouré, par 4 atomes d'oxygène à 276 pm situé au sommets d'un tétraèdre. Ce type d'associations par liaison hydrogène dans la glace entraîne : - une température de fusion élevée - de grandes enthalpies de fusion (6 kJ/mol) et de vaporisation (40,5 kJ/mol) La structure
de la glace est peu compacte : la masse volumique de la
glace qest infétieure à celle de l'eau.
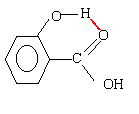
le fluorure d'hydrogène HF, l'ammoniac NH3, l'acide acétique CH3CO2H, l'eau oxygénée H2O2 possédent des liaisons hydrogène intermoléculaires. L'acide salycilique possède une liaison hydrogène intramoléculaire.
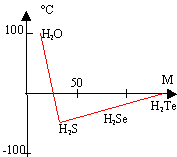
Température d'ébullition normale en fonction de la masse molaire des hydrures.
les
températures d'ébullition augmentent avec la
masse molaire sauf pour l'eau où la valeur est
anormalement élevée. Explication :
présence de liaisons hydrogènes
intermoléculaires formant des associations
moléculaires.
en solution diluée un ion de charge e, placé dans un champ électrique E, acquiert une vitesse limite v0 résultant des forces de freinage dues à la viscosité du milieu. Le rapport u =v0 / E est appelé mobilité ionique (m² V-1 s-1). Celles-ci s'échelonnent entre 2 10-8 et 10 10-8 à l'exception des ions HO- ( 20 10-8 ) et des ions oxonium H3O+ (36 10-8 ). La mobilité u des ions peut être reliée à la conductivité de la solution: Calculons la quantité d'électricité qui traverse pendant le temps dt une surface S perpendiculaire au champ électrique. Pendant le temps dt, les cations contenus dans le volume Sv0+dt vont traverser S, ainsi que les anions contenus dans le volume Sv0-dt. C étant la concentration de la solution, il y a CSv0+dt moles de cations dans le volume Sv0+dt. la charge électrique associée est dq = F CSv0+dt , F étant le Faraday. de même pour les anions, soit au total dq= F CS(v0++ v0- )dt cela correspond à un courant I= dq/ dt = F CS(v0++ v0- ). résistance électrique de la solution ; R= 1/g l /S soumise à une tension U, l'intensité est I=U/ R avec U=El . I= El /R = EgS. par suite : Eg = F C(v0++ v0- ). g = F C(u++ u- ). conductivité
molaire Lm=
g /C =
F
(u++
u- ).
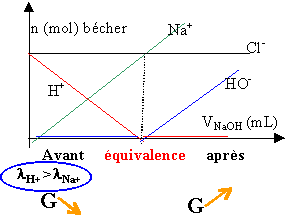
avant équivalence : Les ions hydroxydes HO- ajoutés (burette) réagissent avec les ions oxonium H3O+ en donnant des molécules d'eau. Les ions sodium Na+ ont une conductivité inférieure à celle des ions oxonium : la conductance de la solution diminue. après équivalence : l'ajout d' ions hydroxyde de mobilité assez grande et des ion sodium, fait croître la conductance de la solution. La conductance variant avec la dilution, on ajoute soit
un grand volume de solvant avant de commencer les mesures,
soit une solution titrante concentrée (microburette)
afin que le volume de la solution puisse être
considéré comme constant. La
température doit être maintenue
constante.
La conductivité équivalente limite d'un électrolyte est égale à la somme des conductivités équivalentes limites des ions. (loi de Kohlaursh L0 = L + + L- ). L(KOH) =L(KCl)
-L(NaCl) +L(NaOH)
= 15 -12,6 + 24,8 = 27,1
S m² mol-1.
application n umérique : T1 = 298K; T2 = 323 K; DH= 56 103 J/mol; Ke1 = 10-14; ln 10-14 = -32,23. ln Ke2 = -32,23+56 103/ 8,31 (1/ 298 -1/ 323) -32,23 + 6739(3,3557 10-3 -3,096010-3)= -32,23+1,75 = -30,48. ln Ke2 = 5,8 10-14 . [H3O+][HO-] = 5,8 10-14 . pH en milieu neutre : [H3O+]=[HO-]= 2,4 10-7 . pH= -log2,4 10-7 =
6,61.
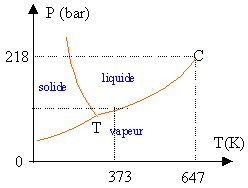
Le point triple de l'eau est à 273,16 K. Ce point fixe de l'échelle internationale des températures sert à définir le Kelvin. Le zéro de l'échelle Celcius est à 273,15 K, point de fusion de la glace sous la pression normale. la lyophilisation : extraire l'eau des substances organiques ou minérales par utilisation des techniques du froid et du vide. Le produit est d'abord congelé à basse température puis placé dans un récipient où l'on fait le vide. La diminution de la pression au dessous du point triple de l'eau , sublime la glace avec le minimum de modification des structures. Cette technique permet de conserver pendant de longues périodes des substances fragiles, produits alimentaires, souches microbiennes, plasma sanguin. |
||||||||
|
retour - menu |
||||||||
|