|
Capes 74 .
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
corrigé |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les solvants ionisants ont la propriété de solvater les ions, ces derniers fixant une ou plusieurs molécules du solvant. Ce phénomène de solvatation libère une énegie de l'ordre de grandeur de l'énergie réticulaire et permet de dissoudre le cristal ionique. Dans le cas de l'eau la permittivité par rapport au vide est er =78,5 à 25°C. L'eau peut dissoudre de nombreux composés ioniques, des gaz (HCl, NH3), des composés organiques (glucose). solubilité des fluorures alcalins : La dissolution se fait d'autant mieux que l'énergie de dissolution DH dissol est grande ( en valeur absolue), soit DH dissol négatif. Cette énergie de dissolution est la somme de l'énergie d'hydratation des ions ( négative : phénomène exothermique) et l'énergie réticulaire (positive). L'énergie d'hydratation et l'énergie réticulaire décroissent de Li+ à Cs+; mais l'énergie réticulaire décroît plus vite que l'énergie d'hydratation.
nivellement des acides et des bases : En solution dans l'eau un acide AH plus fort que H3O+ se dissocie totalement : AH +H2O --> H3O+ + A-. On ne peut comparer dans l'eau les acides plus forts que H3O+: il y a nivellement des forces de ces acides. On utilise un solvant plus acide que l'eau pour comparer la force de ces acides, par exemple l'acide éthanoïque. 2 CH3COOH en équilibre avec CH3COOH2+ + CH3COO-. On pourra classer les acides moins forts que l'ion acéthyloxoniumCH3COOH2+, ces acides n'étant pas entierement ionisés. On effectue des mesures de conductivité. La force des acides diminue dans l'ordre suivant: HClO4 > HBr > H2SO4 > HCl >HNO3. solubilité de CaSO4 : Le produit de solubilité s'écrit : [Ca2+][SO42-]=Ks Si x et y sont les concentrations des ions en solution le produit xy doit être constant à température fixée.
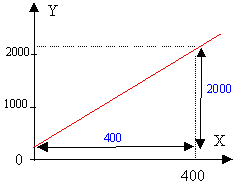
Soit C la concentration des agrégats, alors [Ca2+]= x-C et [SO42-] = y-C le produit de solubilité s'exprime par la relation : Ks = (x-C)(y-C) Ks = xy +C² -C(x+y) soit : xy = Ks-C²+C(x+y). posons Y= xy et X = x+y on représente la fonction: Y = Ks -C² + CX
la courbe est une droite: les hypothèses émises sont vérifiées. pente de la droite C = 2000/400 = 5 mmol/L = 5 10-3 mol/L oordonnée à l'origine : voisine de 200 mmol² / L² = 200 10-6 mol²/L² 200 10-6 = Ks - C² = Ks - (5 10-3 )² d'où Ks = 225 10-6 mol² /L².
retour - menu |