|
|
Le
noir d'ériochrome T ( NET) ( formule ci-dessous) est un colorant
synthétique largement utilisé dans l'industrie textile, dont la
dégradation biologique est difficile.
Nous allons étudier sa dégradation par le procédé électro-Fenton.
On suit l'évolution de la concentration en NET par spectrophotométrie à la longueur d'onde l0=540 nm.
Détermination de la concentration en NET.
En général, la longueur d'onde de travail correspond au maximum d'absorption de la substance étudiée. Justifier ce choix.
A cette longueur d'onde, le coefficient d'exctinction molaire est maximum.
L'absorbance est proportionnelle à ce coefficient et à la concentration de la substance étudiée.
A une petite variation de la concentration correspond une variation
assez grande de l'absorbance : la sensibilité de la méthode
est maximale.
Quelle grandeur mesure t-on avec le spectrophotomètre ? Comment la relier en concentration en NET du milieu ?
Un spectrophotomètre mesure l'absorbance A
(grandeur sans unité) d'une solution diluée
colorée contenue dans une cuve.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique)
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
e
(L mol-1
cm-1) est une caractéristique
de la molécule. Plus e
sera grand, plus la solution absorbe.
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Absorbance et concentration étant
proportionnelles, cette relation peut être
utilisée pour réaliser des dosages ou des
suivis cinétiques.
A 540 nm seul le NET absorbe : A = e l [NET]
|
|
On veut proposer à des élèves de terminale S, en travaux pratiques, la détermination d'une concentration c0 en NET d'une solution S0 fournie.
Expliquer avec concision le protocole expérimental.
|
On prépare une échelle de teintes
à partir d'une solution S de
concentration c connue en NET.
On
prépare 5 solutions étalons à partir de
la solution précédente en suivant le processus
suivant : on prélève V0 mL de
S que l'on verse dans une fiole jaugée de
50 mL et on complète avec de l'eau distillée
jusqu'au trait de jauge.
|
solution
|
S1
|
S2
|
S3
|
S4
|
S5
|
|
volume V0 (mL)
|
5
|
10
|
15
|
20
|
25
|
On dispose ainsi d'une échelle de teintes.
Réglage du spectrophotomètre sur la
valeur "zéro " : placer dans la cuve le solvant l'eau
distillée, régler sur l'absorbance
nulle.
Ainsi les mesures de l'absorbances des solutions correspondront aux diverses concentrations de la
seule espèce colorée,le NET.
On mesure l'absorbance des solutions
préparées.
La courbe obtenue est une droite " étalon" : la loi de
Beer-Lambert A = k. [ NET ] est donc
vérifiée.
On mesure l'absorbance de la solution étudiée S : la droite "étalon " permet de trouver la concentration en NET.
La valeur c0 choisie peut-elle être quelconque ?
La concentration c0 doit conduire à une absorbance
inférieure à la l'absorbance maximale admissible pour le
spectrophotomètre ( A < 2 ou A < 5 suivant l'appareil ).
En quoi le protocole doit-il être adapté à cette valeur c0 ?
L'absorbance correspondant à c0 doit se situer pratiquement dans la partie centrale de la droite "étalon".
Etablir la liste de matériel nécessaire à cette séance de TP.
Spectrophotomètre + 6 cuves ; eau distillée ; pipettes pasteur.
Préparation des solutions "étalons" : pipettes jaugées ou burette graduée de 25 mL + fioles jaugées de 50 mL.
Solution S0 de concentration c0 en NET.
Prévoir éventuellement pipette et fiole jaugée pour la dilution de la solution S0 de NET.
Etude cinétique.
On obtient les résultats suivants :
t (min)
|
0
|
1
|
2
|
3
|
4
|
5
|
105 (NET] mol L-1.
|
5,00
|
2,12
|
0,89
|
0,38
|
0,16
|
0,07
|
L'équation relative à l'action des radicaux HO. sur le net s'écrit :
NET + HO. --> produits de dégradation incolores
la vitesse de cette réaction peut se mettre sous la forme :
v = k [NET]a [HO.]ß.
Expliquer pourquoi on peut considérer comme constante la concentration en HO. au cours du temps.
Ces radicaux sont issus d'une électrolyse pratiquée à intensité constante : leur production est donc régulière.
Ces radicaux sont très réactifs, ils réagissent rapidement dès qu'ils sont formés.
Leur concentration dans le milieu réactionnel peut donc être considérée comme constante.
Déduire des résultats expérimentaux l'ordre partiel en NET et la valeur de la constante apparente kapp que l'on définira.
kapp = k[HO.]ß.
Hypothèse : ordre partiel ß =1.
v = -d[NET] / dt = kapp[NET]
d[NET] / (NET] = -kapp dt
intégrer entre t= 0 et t : ln ( [NET] / c0) = -kapp t.
|
|
Dans cette hypothèse on trace la courbe d'équation :
ln ( c0 / [NET] ) = f( t).
t(min)
|
0
|
1
|
2
|
3
|
4
|
5
|
| 105 (NET] mol L-1. |
5,00
|
2,12
|
0,89
|
0,38
|
0,16
|
0,07
|
| c0 / [NET] |
1
|
5/2,12 =2,36
|
5/0,89 =5,61
|
5/0,38 =13,2
|
5/0,16=31,3
|
5/0,07 =71,4
|
| ln ( c0 / [NET] ) |
0
|
0,858
|
1,73
|
2,58
|
3,44
|
4,27
|
|
|
xxxx
|
0,858
|
1,73/2 =0,865
|
0,860
|
0,86
|
0,854
|
Valeur moyenne kapp = 0,86 min-1.
ln ( c0 / [NET] ) et le temps sont proportionnels : l'hypothèse ß = 1 est vérifiée.
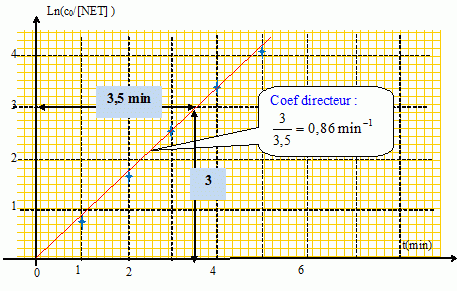
La courbe est une droite : l'hypothèse ß = 1 est vérifie.
Le coefficient directeur de la droite donne kapp.
|
.
|
|