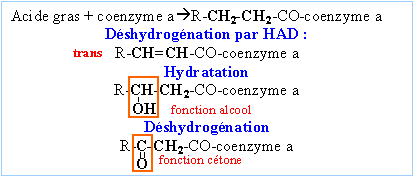
|
||||
|
oléine |
corrigé |
|||
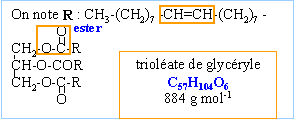
classification des lipides : hydrosoluble et liposoluble oxydation en b du carbone de l'ester
|
||||
|
saponification |
On désire fabriquer un savon à partir d'oléine et d'une solution d'hydroxyde de potassium.
corrigé |
|||
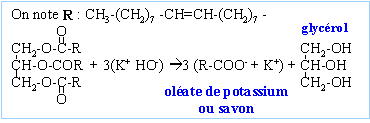
masse molaire du savon C18 H33 O2 K : 320 g/mol Qté de matière d'oléine : 221 /884 = 0,25 mol Qté de matière de savon : 3*0,25 = 0,75 mol masse théorique de savon : 0,75 *320 = 240 g en tenant compte du rendement : 240 *0,65 = 156 g relargage : le savon est insoluble dans l'eau salée; cela permet de séparer le savon du glycérol et de la solution de potasse en excès. pouvoir nettoyant : Le groupe carboxylate -COO- , s'entoure facilement de molécule d'eau ; il constitue la partie hydrophile du savon. La longue chaine carbonée a une grande affinité pour les graisses; elle constitue la partie lipophile (hydrophobe) du savon. Par son extrémité lipophile le savon fixe les graisses, et par son extrémité hydrophile il les solubilise.
|
||||
|
indice d'iode |
corrigé |
|||
|
L'indice d'iode permet de connaître le degré d'insaturation (présence de liaison double C=C). c'est la masse de diiode fixée par 100 g de produit trois liaisons doubles C=C dans l'oléine peuvent fixées 3 molécules de diiode. 1 mole d'oléine (884 g) fixe 3 moles de diiode soit 3 *(127*2) = 762 g indice d'iode : 762/884*100= 86 retour - menu |