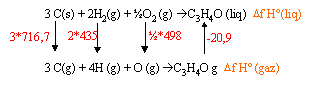|
|
||||||||||||||||||||
|
||||||||||||||||||||
|
L'acroléïne CH2=CH-CHO est un liquide dans les conditions standarts à 298°C.
données : DH° combustion acroléine = -1630 kJ/mol ; DH°(H2O liq) = -285,3 kJ/mol ; DH°(CO2 gaz) = -393,5 kJ/mol ; DH° sublimation C(s) = 716,7 kJ/mol ; DH° vaporisation acroléine (liq) = 20,9 kJ/mol ; enthalpie de formation des liaisons
(kJ/mol ) 804 dans CO2 corrigé |
||||||||||||||||||||
|
C3H4O (liq) + 3,5 O2 donne 3 CO2 (gaz) + 2 H2O (liq) DH° combustion = 2 DH° (H2O(liq)) + 3 DH°(CO2 (gaz)) - Df H°(C3H4O (liq)) Df H°(C3H4O (liq)) = 2 DH° (H2O(liq)) + 3 DH°(CO2 (gaz)) - DH° combustion Df H°(C3H4O (liq)) = 2*(-285,3) + 3*(-393,5) - (1630) = -121,1 kJ/mol. à partir des énergies de liaisons : réaliser un cycle Df H°(C3H4O (liq)) = 3*716,7 +870 +249 + Df H°(C3H4O (gaz) -20,9 = 3248,2 +Df H°(C3H4O (gaz) liaisons créees : C=C ; C=O; 4 C-H ; C-C Df H°(C3H4O (gaz) = - S énergies de liaisons des liaisons créees + S énergies de liaisons des liaisons rompues Df H°(C3H4O (gaz) = -620 +-340 -4*415 -720 = -3340 kJ/mol Df H°(C3H4O (liq)) = 3248,2 -3340 = -91,8 kJ/mol. le calcul à partir des énergies de liaisons est imprécis et donne seulement un ordre de grandeur.
|
||||||||||||||||||||
|
Soit la réaction équilibrée CO(g) + H2O(l) = CO2(g) + H2(g) avec Df H° = -43,51 kJ/mol
corrigé |
||||||||||||||||||||
|
une augmentation de température favorise une réaction endothermique, donc déplacement de l'équilibre vers la gauche. l'augmentation de la concentration de la vapeur d'eau déplace l'équilibre à droite, consommation de la vapeur d'eau
constante d'équilibre : K = PH2 * PCO2 / (PH2O * PCO) K = x² / [(a-x) (b-x)] indépendant de la pression totale. si a=b=1 mole alors à 450°C :K =7,14 7,14(1-x)(1-x) = x² 6,14 x² -14,28 x + 7,14 =0 résoudre x = 0,728 mol. composition du mélange : 0,728 mol H2 et CO2; 0,272 mol H2O et CO. si a=1 et b=10 mol alors à 450°C :K =7,14 7,14(1-x)(10-x) = x² 6,14 x² -71,4 x + 64,26 =0 résoudre x = 0,993 mol. composition du mélange : 0,993 mol H2 et CO2; 9,017 mol H2O et 0,017 mol CO. l'équilibre précédent a bien été déplacé à droite. influence de la température : d lnK / dT = D H° / (RT²) dlnK = D H° / R d(-1/T) intégrer entre T1 = 450+273 = 723 K et T2 =350+273 = 623 K ln (K2/ K1 ) =D H° / R(1 / T1 - 1/T2 ) avec K1 =7,14 ln (K2 / 7,14) = -43510 / 8,31 ( 1 / 723 -1 / 623) = 1,135 K2= 7,14 exp 1,135 = 22,25. une diminution de température en passant de 450°C à 350°C favorise la réaction exothermique ; déplacement de l'équilibre à droite et augmentation de K.
retour - menu |