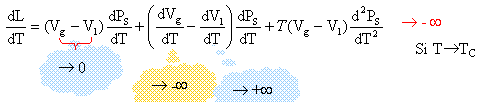|
Capes interne 91
|
|||
|
|||
|
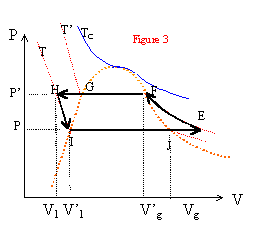
On s'intéresse à la chaleur latente L de vaporisation en fonction de la température.
|
|||
|
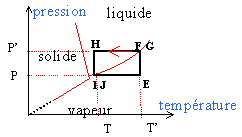
transformation isotherme E--> F : DUEF = 0 = WEF + QEF. changement d'état F-->G : DUFG = WFG + QFG. WFG = -P' (V'l-V'g) voisin de P'V'g et QFG = -L' transformation isobare G-->H : DUGH = WGH + QGH. WGH = -P' (Vl-V'l) voisin de zéro et QGH = Cp(T-T') transformation isotherme H--> I : DUHI = 0 = WHI + QHI changement d'état I-->J : DUIJ = WIJ + QIJ. WIJ = -P (Vg-Vl) voisin de -PVg et QIJ = L transformation isobare J-->E : DUJE = WJE + QJE. WJE = -P (VE-Vg) et QJE = Cpg(T'-T) la somme des variations d'énergie interne est nulle sur le cycle: P'V'g -L' + Cp(T-T') -PVg + L-P (VE-Vg)+Cpg(T'-T)=0 utiliser l'équation des gaz parfaits avec n= 1 mole: L-L' +RT' -RT -RT' +RT + Cp(T-T') +Cpg(T'-T)=0 L-L' = (Cp-Cpg) (T-T'). L=L' + (Cp-Cpg) (T-T').par analogie avec L=L0 -aT L0 = L' + (Cp-Cpg) T' et a = Cp-Cpg
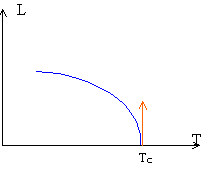
quand T tend vers TC: le volume du gaz tend vers le volume du liquide: Vg --> Vl et L tend vers zéro. calculer la dérivée dL/dT :
La dérivée de Vg tend vers l'infini car d'après la figure 3, une légère augmentation de température au voisinage de TC entraîne une diminution de Vg. par contre une légère augmentation de température entraîne une augmentation de Vl au voisinage de TC: en conséquence la dérivée de Vl tend vers l'infini.
retour - menu |