|
BTS
|
|||
|
|||
|
Une mole de gaz parfait subit les transformations réversibles suivantes : état (1) à état (2) compression adiabatique état (2) à état (3) dilatation à pression constante état (3) à état (4) détente adiabatique état (4) à état (1) refroidissement à volume constant Chaque état est défini par la pression Pi, la température Ti et le volume Vi (i variant de 1 à 4). On appelle g le rapport des chaleurs molaires Cp/Cv. On définit a = V1/V2 et b = V4/V3.
Données : g = 1,4 ; P1 = 1,0.105 Pa ; a = 9 ; T1 = 300 K ; b = 3 ; Cv = 20,8 J/K/mol corrigé |
|||
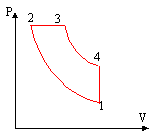
compression adiabatique : P1V1g = P2V2g soit P2 =P1(V1/ V2)g = P1a g . P2 = 105 *91,4 = 2,167 106 Pa. V1/ V2 = a d'où V2 = V1/ a avec P1V1 = RT1soit V1 = 8,31 *300 / 105 = 0,025 m3. et V2 = RT1 / (aP1) = 0,025 /9 = 2, 77 10-3 m3. P2V2 = RT2 soit T2 = P1a g RT1 / (aRP1) T2 =
a g-1T1
= 90,4 *300 =
722,4
K.
P3 = P2 ; V3 = 8,33 10-3 m3 ( calcul ci dessous) P3V3 = RT3 d'où T3 =P2V3 / R = P1a g V1 / (Rb) T3 =105*91,4*0,025 / (8,3*3) = 2176 K.
P3V3g = P4V4g soit P4 =P3(V3/ V4)g = P3/ b g=P1(a/b) g P4 = 105 *31,4 = 4,65 105 Pa. V4 / V3 = b d'où V3 = V4 / b = V1 / b = 0,025 / 3 = 8,33 10-3 m3 avec P4V4 = RT4 soit T4 = P4V1 / R = P1(a/b) g V1 / R. T4 =
105*31,4 *0,025 /8,31 =
1402
K.
adiabatique, donc pas d'échange de chaleur avec l'extérieur travail : W12 = (P2V2 -P1V1) / (g-1) W12 = (21,67
105*2,77 10-3 - 105*0,025)
/ 0,4 = 8 756
J. ( reçu)
pression constante donc W23 = -P2 (V3-V2) W23 = -21,67 105 (8,33 - 2,77)10-3 = - 12 048 J ( cédé à l'extérieur) variation d'énergie interne du gaz Cv (T3-T2 ) DU = 20,8 ( 2176-722,4) = 30 235 J Q23 =
DU-W23
= 30 235 - (-12 048) = 42283
J (reçu)
adiabatique, donc pas d'échange de chaleur avec l'extérieur travail : W34 = (P4V4 -P3V3) / (g-1) W34 = (4,65
105*25 10-3 - 21,67
105*8,33 10-3) / 0,4 =
-16 065
J. ( perdu)
volume constant donc W41 = 0 la chaleur échangée est égale à la variation d'énergie interne du gaz Q41 = Cv(T1-T4) Q41 = 20,8 (300-1402) =
-22 922
J. ( cédé
à l'extérieur)
il représente le taux de conversion en travail de l'énergie thermique reçue. énergie thermique reçue = 42 283 J travail fourni - travail reçu : -16065 -12048 + 8756 = - 19357 J rendement = - (- 19357 )/ 42 283 = 0,46. autre méthode : 1 + Q2 / Q1 avec Q1 chaleur reçue et Q2 chaleur cédée. 1 + (-22 921) / 42 283 = 1 - 0,54 = 0,46.
retour - menu |