|
Analyse détaillée d'exercices réalisés sous forme de QCM. spectrophotométrie |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
Texte : on utilise la
spectrophotométrique pour doser la caféine
dans deux solutions de café, notées
S1 et S2, de concentration respective
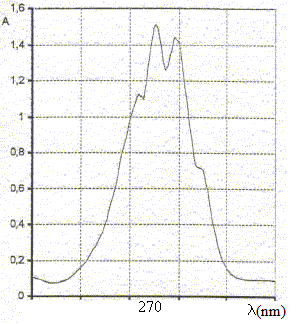
en caféine c1, c2. On mesure l'absorbance à l = 270 nm des solutions de caféine et on trouve :
Questions relative aux courbes et au domaine du spectre électromagnétique.
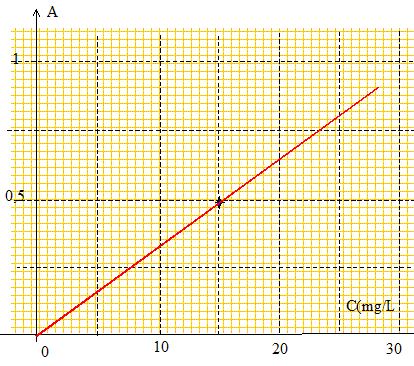
l=270 nm appartient au domaine UV. La valeur de l'absorbance dépend de la longueur d'onde utilisée. L'absorbance est une grandeur sans unité. Les longueurs d'ondes des radiations visibles par l'oeil humain sont comprises entre 400 nm et 800 nm. Questions relatives à l'absorbance et à la concentration. Pour des concentrations assez faibles et pour une longueur d'onde donnée, l'absorbance A d'une solution colorée est proportionnelle à sa concentration. La courbe A=f(C) est une droite passant par l'origine et de coefficient directeur : 0,5/15 = 3,33 10-2 L mg-1. A = 3,33 10-2 c ; c1 = A1 / 3,33 10-2 = 0,4*15/0,5 ; c1 =12 mg/L. c2 = A2 / 3,33 10-2 = 0,6*15/0,5 ; c2 =18 mg/L.
La couleur d'une substance colorée est
celle de la couleur qu'elle diffuse.
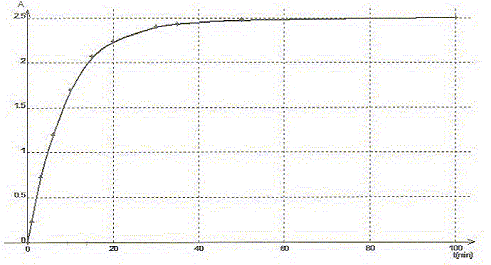
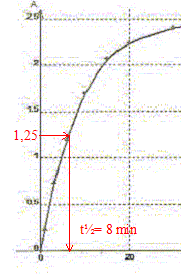
Par spectrophotométrie on suit la cinétique de la réaction des ions iodures I-(aq) avec les ions peroxodisulfate S2O82-(aq) qui conduit à la formation de diiode ( jaune en solution) et d'ion sulfate. Cette réaction est lente et totale. La transformation est modélisée par l'équation chimique : S2O82-(aq) + 2 I-(aq) = I2(aq) + 2SO42- (aq). Les concentrations et volumes des réactifs introduits sont les suivants : S2O82-(aq) : c1 = 0,50 mol/L ; v1 = 10,0 mL I-(aq) : c2 = 0,020 mol/L ; v2 = 10,0 mL. On a mesuré l'absorbance au cours du temps et obtenu la courbe ci-dessous : On rappelle la loi de Beer aux faibles concentrations : A = k [I2] où k est un coefficient de proportionalité.
A. Le temps de demi-réaction t½ vaut environ 30 min. Faux.
B. L'ion peroxodisulfate est le réactif limitant. Faux. Quantité de matière d'ion S2O82-(aq) : c1v1 = 0,5*10 = 5 mmol Quantité de matière d'ion I-(aq) : c2v2 = 0,02*10 = 0,2 mmol à partir de 0,2 mmol d'ion I-(aq) il faut, d'après les coefficients stoechiométriques, 0,1 mmol d'ion S2O82-(aq) : or on en a 5 mmol. S2O82-(aq) est en large excès. C. La réaction étant totale, la concentration finale doit être [I2]max= 10 mmol/L. Faux. [I2]max=½[I-(aq)]initial =c2v2 /(v1+v2) =0,1/20= 5 10-3 mol/L = 5 mmol/L D. La valeur de k pour la longueur d'onde choisie est 5,0 102 L mol-1. Amax = k
[I2]max ; k=Amax
/[I2]max=2,5 / 5
10-3 = 500 L mol-1. Vrai.
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
|