|
Analyse détaillée d'exercices réalisés sous forme de QCM. cinétique, acide base, ester. |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Texte : Le sulfate de cuivre est hydraté à l'état solide. Placé dans une étuve, un échantillon de 36 g a une masse finale de 23 g. M(CuSO4) = 159,5 g/mol ; M(H2O) = 18 g/mol. Analyse : La formule de sel cel hydraté est : CuSO4, 4H2O ; CuSO4, 5H2O ; CuSO4, 6H2O ; CuSO4, 7H2O. Quantité de matière de CuSO4 : n = m/M = 23 / 159,5 =0,144 mol. Masse molaire du sel hydraté CuSO4, x H2O ; 159,5 + 18 x par suite : 0,144 = 36/ (159,5 + 18 x) ; 159,5 + 18 x = 36/0,144=250 ; x = (250-159,5)/18 ; x=5. Texte : solution de iodure de
potassium KI : V= 50 mL ; c1 = 0,80
mol/L ; solution de peroxodisulfate de potassium : V= 50
mL ; c2 = 0,60 mol/L ; Analyse : Question relative aux
espèces colorées. Seul le diiode I2 aq est
coloré ( jaune brun). Question relative au
réactif limitant. Quantités de matière initiales :
n(KI) = V c1 = 0,05*0,8 =0,04 mol. n(S2O82-
) = V c2 = 0,05*0,60 =0,030
mol. Hypothèse 2
:S2O82-
aq en défaut :
0,03-xmax =0 ; xmax =0,03
mol. Retenir la plus petite valeur : xmax
=0,02 mol,
I-
aq en défaut,
réactif limitant. Question relative
à la vitesse volumique. La vitesse est toujours positive. La vitesse est proportionnelle à la
dérivée de l'avancement par rapport
au temps et inversement proportionnelle au volume
de la solution. v = 1/Vsol dx/dt. La vitesse décroît au cours du
temps du fait de la diminution de la concentration
des réactifs.
Solution d'ammoniac NH3 et d'acide chlorhydrique. Texte : titrage de la solution d'ammoniac par une solution d'acide chlorhydrique Analyse : Question relative à l'équation de la réaction. Couples acide / base : NH4+aq / NH3 aq ; H3O+aq / H2O(l). NH3 aq + H3O+aq =NH4+aq + H2O(l). Question relative au pH du point équivalent. A l'équivalence on a une solution de chlorure d'ammonium NH4+aq + Cl-aq. L'ion ammonium réagit partiellement avec l'eau : NH4+aq +H2O(l) = NH3 aq +H3O+aq . Le pH de la solution est donc un peu inférieur à 7. Question relative à la demi-équivalence. A la demi équivalence du dosage, [NH4+aq]=[NH3 aq]. Il s'agit d'une solution tampon dont le pH est égal au pKa du couple NH4+aq / NH3 aq.
Cinétique suivi par mesure de pression. Texte : Fe(CO)5 (g) = Fe(s) + 5 CO (g), totale à 450 K. Quantité de matière initial du réactif : n0 = 2,0 10-3 mol dans V0 = 500 mL = 5 10-4 m3 à température T constante. Les gaz sont assimilés à des gaz parfaits. R = 8,32 J K-1 mol-1. Analyse : Question relative à la relation entre l'avancement et la pression.
Relation des gaz parfaits : PV = nRT s'écrit : PV = (n0+4x)RT = n0RT + 4xRT. (1) A l'instant initial : P0V = n0RT ; (1) s'écrit : PV = P0V+4xRT ; 4xRT = V(P-P0) = 4xRT x = 0,25V/ RT *(P-P0) avec 0,25 V/(RT) = 0,25 n0/P0. x = 0,25 n0(P-P0)/P0 ; x = 0,25 n0 (P/P0-1). Par exemple si P = 2P0 alors x = 0,25 n0 = 5 10-4 mol.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
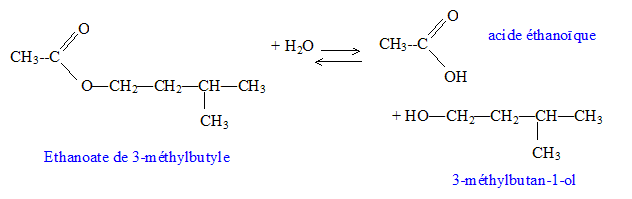
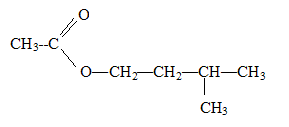 C7H14O2.
C7H14O2.