|
Concours kiné Berck : 9 années de QCM acide base. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Quelles sont les bonnes affirmations ? Une solution d'acide méthanoïque a un pH plus faible qu'une solution d'acide chlorhydrique de même concentration. Faux. L'acide chlorhydrique est un acide fort (pKa=0). L'acide éthanoïque un acide faible A concentration égale le pH de l'acide chlorhydrique est plus petit que celui de la solution d'acide éthanoïque. Une solution d'acide méthanoïque a un pH plus faible qu'une solution d'acide éthanoïque de même concentration. Vrai. De deux acide faibles de même concentration, l'acide le plus fort (pH le plus petit) est celui qui a le plus petit pKa. Une solution de méthanoate de sodium et une solution de chlorure de sodium de même concentration ont le même pH. Faux. L'ion méthanoate est une base faible: le pH de la solution de méthanoate de sodium est supérieur à 7 ; l'eau salée est un milieu neutre. Une solution d'acide méthanoïque qui est telle que [HCOO-]=10[HCOOH] a un pH de 4,8. Vrai. pH = pKa + log [ ion méthanoate] / [acide méthanoïque] = 3,8 + log 10 = 4,8. La réaction entre l'acide méthanoïque et l'hydroxyde de sodium est totale. Vrai. Réaction acide faible base forte avec une grande différence des pKa : ( 14- 3,8).
acide benzoïque/ ion
benzoate Ka =6,3 10-5 ;
pKa = 4,2 Quel est le pH de la
solution
? couples acide /base :
C6H5-COOH /
C6H5-COO- et
H2O/HO-. La différence des
pKa étant grande, la
réaction est totale. solution
tampon
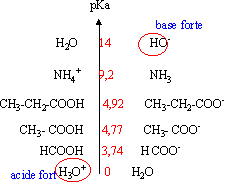
On donne les constantes d'acidité de quelques couples du type R-COOH / R-COO- avec R radical alkyle. H-COOH / H-COO- : pKa = 3,74 H3C-COOH / H3C-COO- : pKa = 4,77 H3C-CH2-COOH / H3C-CH2-COO- : pKa = 4,92 On rappelle également pour le couple ion ammonium / NH3 : pKa = 9,2 Parmi les affirmations suivantes, quelles sont celles qui sont exactes ?
L'augmentation de la taille du radical alkyle R augmente la basicité de la base du couple. Vrai. L'acide propanoïque est un acide plus fort que l'ion ammonium. Vrai. L'ion méthanoate est une base plus forte que l'ammoniac. Faux. La réaction entre l'ion ammonium et l'ion méthanoate est quasi-totale. Faux. La réaction entre l'ammoniac et l'acide propanoïque est totale, pas la réaction inverse. La diminution de la taille du
radical alkyle R augmente l'acidité de l'acide du
couple.
Vrai.
Parmi les affirmations suivantes combien y en a
t-il d'exactes ? à pH supérieur à pKa+1 la
forme In- prédomine, donc couleur
jaune CH3-COOH+HO- -->CH3-COO-+H2O à l'équivalence du dosage la base conjuguée CH3-COO- est majoritaire, donc le pHéqui est supérieur à 7. Or la zone de virage de l'indicateur coloré doit
contenir le pHéqui. 0,01 / 24 = 4,16 10-4 mol HCl ; [H3O+]=4,16 10-4 /0,25 = 1,66 10-3 mol/L pH = -log1,66 10-3 = 2,78. donc
l'hélianthine est rouge. pH= pKa + log([In-]/[InH]) ; pH= 3,8 + log 3 =4,3.
On dispose d'une solution d'acide chlorhydrique commerciale . Sur l'étiquette on lit : densité = 1,19 ; pourcentage massique en chlorure d'hydrogène 36% ; masse molaire HCl : 36,5 g/mol. Quel volume ( en mL) de la solution commerciale doit-on prélever pour préparer 3 L de solution d'acide chlorhydrique à 0,02 mol/L ? 1190 *0,36 / 36,5 = 11,74 mol/L pour la solution du commerce. Qté de matière de HCl: 3*0,02 = 0,06 mol 0,06 = 11,74 Vcommercial soit
Vcommercial = 5,1 10-3 L =
5,1
mL.
CaVAéq=CbVb
soit Cb =
CaVAéq/Vb
=0,1*15/10=0,15 mol/L [H3O+][HO-]=2
10-15 ; [H3O+] =
10-11,4 = 4 10-12 mol/L ;
Calculer la valeur du taux
d'avancement final ( en %) de cette
réaction. (3,7 ; 5,4
; 6,2 ; 8,8 ; 9,7 ; aucune réponse) |
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|