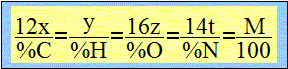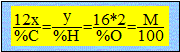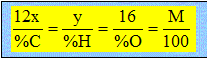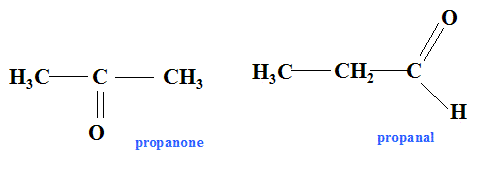|
Analyse détaillée d'exercices réalisés sous forme de QCM. chimie organique : recherche d'une formule brute. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
Texte : l'aspartame est un édulcorant constitué que de carbone, d'oxygène,d'hydrogène et d'azote. La combustion complète de 0,01 mol d'aspartame conduit à 1,62 g d'eau. On donne la composition massique de ce édulcorant : C : 57,14 % ; O : 27,22 % ; N : 9,52 % ; H : 6,12% Masses molaires en g/mol : H : 1 ; C : 12 ; O : 16 ; N : 14 Analyse : Question relative à la formule brute de l'aspartame. On note CxHyOzNt la formule brute de l'aspartame et M sa masse molaire. x, y, z, t, nombres entiers positis. Exprimer la masse d'eau en mole : m/M =1,62 / 18 = 0,09 mol d'eau à partir de 0,01 mol d'aspartame. CxHyOzNt + .... O2 conduit à ....... + ½y H2O. 0,01 mol.............................................0,09 mol 1 mol............................................. 9 mol soit y = 18. Chercher des relations entre x, y, z et t : 12 x / 57,14 = y / 6,12 ; 0,21 x = 0,163 y ; x = 0,163/0,21 y x = 0,163/0,21*18 ; x=14. y / 6,12 = 16z/ 27,22 ; 0,163 y = 0,588 z z = 0,163*18/0,588 ; z = 5.
t = 0,163*18 / 1,47
; t =
2. C14H18O5N2
aldehyde, cétone. Texte : la combustion complète de 1,2 g d'un composé A donne 2,73 g de dioxyde de carbone et 1,12 g d'eau. Analyse : Question relative l'équation de la réaction. Formule brute : CxHyO avec x, y entiers. CxHyO + (x+0,25 y-0,5)O2 = xCO2 + ½y H2O. (1) Question relative aux quantités de matière (mol). M(H2O) = 18 g/mol ; M(CO2) = 44 g/mol. n(H2O) = 1,12/18 =0,062 mol ; n(CO2) =2,73/44 =0,062 mol. Question relative à une relation entre x et y.
Question relative aux pourcentages massiques. Dans 1,12 g d'eau il y a 1,12*2/18 = 0,124 g d'élément hydrogène. Il y a 0,124 g d'élément hydrogène dans 1,2 g de A soit : 0,124/1,2 *100 =10,3 % H. Dans 2,73 g de CO2 il y a 2,73*12/44 = 0,745 g de carbone. Il y a 0,745 g d'élément carbone dans 1,2 g de A soit : 0,745/1,2 *100 =62,1 % C. %O = 100 -10,3-62,1 = 27,6 %. Question relative à la formule brute. Formule brute : CxHyO avec x, y entiers. Masse molaire M = 12x + y +16 = 12x + 2x + 16 = 14 x +16.
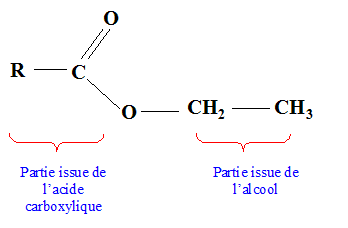
y/10,3 = 16/27,6 soit y =6. 12x /62,1 = 16/27.6 soit x = 3. C3H6O Question relative aux formules semi-développées.
|
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|