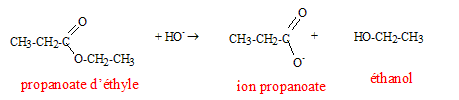|
Analyse détaillée d'exercices réalisés sous forme de QCM. ester ; hydrolyse acide, hydrolyse basique ou saponification |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
Texte : conditions expérimentales : soude assez concentrée et chauffage à reflux.. Analyse : Questions relatives à la réaction. Cette réaction s'appelle " hydrolyse basique " ou " saponification". Cette réaction est lente mais totale : elle ne conduit pas à un état d'équilibre. Questions relatives aux produits.
L'un des produit formé est l'éthanol et non pas le propanol. L'autre produit formé est l'ion propanoate ( majoritaire en milieu basique par rapport à l'acide propanoïque), base conjuguée de l'acide propanoïque.
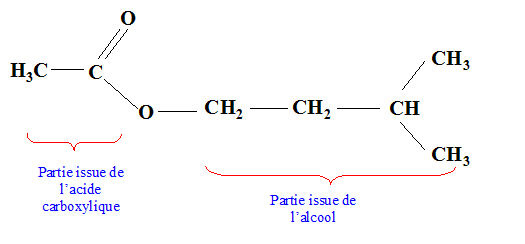
CH3-COO-CH2-CH2-CH(CH3)2.
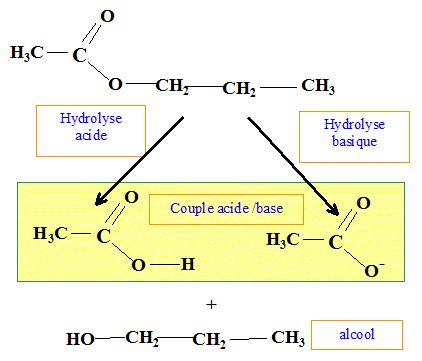
Hydrolyse acide, hydrolyse basique. Formule brute : C5H10O2 : En milieu acide, l'hydrolyse donne un corps A et un corps B. En milieu basique, l'hydrolyse le même corps A et un corps D. Analyse : Question relative à l''hydrolyse.
Le corps A est un alcool : B est un acide carboxylique. L'hydrolyse acide est limitée ; l'hydrolyse basique est lente mais totale. Le corps B se transforme en D en milieu basique. acide carboxylique + HO- = ion carboxylate + eau.
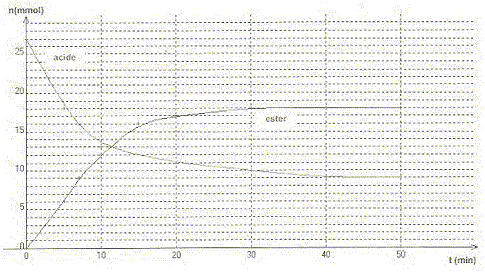
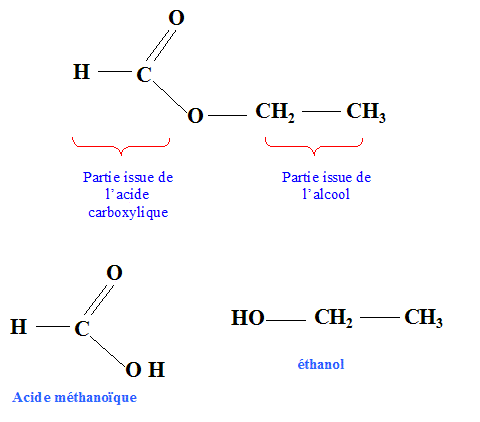
Le méthanoate d'éthyle. Texte : mélange initial équimolaire en acide carboxylique et en alcool. L'évolution des quantités d'ester et d'acide en fonction du temps sont données.
Analyse : Questions relatives aux noms des réactifs.
Questions relatives à la constante d'équilibre. Le tableau d'évolution est établi pour 27 mmol d'alcol et 27 mmol d'acide ( valeur lue sur le graphe ci-dessus) ; le volume total est noté V (mL).
[HCOOH]éq=(27-xéq)/V = 9/V ; [CH3-CH2OH]éq=(27-xéq)/V =9/V; [HCOO-CH2-CH3]éq=18/V ; [H2O]éq=18/V. K = [H2O]éq[HCOO-CH2-CH3]éq/ ([HCOOH]éq[CH3-CH2OH]éq) K =182/92 = 4. Question relative au taux d'avancement final. t = xéq/xmax = 18 /27 = 0,67 (67 %) Question relative à la pureté de l'ester. La mesure de latempérature d'ébullition de l'ester ne permet pas de contôler sa pureté. La chromatographie sur couche mince (CCM) permet de contôler la pureté.
Texte : un
dispositif de chauffage à reflux contient : n moles
de palmitate de myricyle, 100 mL d'une solution alcoolique
d'hydroxyde de potassium à 0,30 mol/L. Question relative aux réactions. hydrolyse basique ou saponification lente, totale. Question relative à la
formule du savon. Question relative à quantité de matière de potasse. Qté de matière de potasse initiale :
0,3*100 = 30 mmol A l'équivalence du dosage acide base, les quantités de matière d'acide et de base mises en présence sont en proportions stoechiométrriques d'où 10*0,15 = 1,5 mmol Question relative à la masse de savon. CH3-(CH2)14COO-(CH2)29-CH3
+ HO- +K+=
CH3(CH2) 14-COO-
+
K++HO-(CH2)29-CH3 M(savon) = 16*12+31+32+39=294 g/mol |
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
|