|
Analyse détaillée d'exercices réalisés sous forme de QCM. Electrolyse
|
||||||||
|
||||||||
|
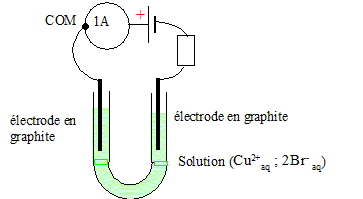
Texte : solution de bromure de cuivre (II) : volume V = 200 mL ; concentration C = 0,25 mol/L ; intensité constante I = 1 A pendant une durée Dt = 15 min. Observations : dépôt
métallique sur une électrode et coloration
rouge brune de la solution sur l'autre.
Analyse : Question relative aux réactions aux électrodes. A la cathode négative, réduction des ions cuivre (II) : Cu2+aq + 2e- = Cu(s). Le dépôt métallique se produit toujours à la cathode. A l'anode positive, oxydation des ions bromure Br-aq : 2Br-aq = Br2 +2e-. Question relative à la quantité d'électricité. Q= I Dt avec Dt = 15*60 = 900 s. Q = 1*900 = 900 C=900 /3600 = 0,25 Ah. Or Q = 96500 n(e-) d'où n(e-) =900/96500 =9,33 10-3 mol.
Cu2+aq + 2e-
= Cu(s). n(Cu(s ) anode) = ½
n(e-) =0,5*9,33 10-3 = 4,66
10-3 mol. masse g) = quantité de matière
(mol) * masse molaire (g/mol) m = 4,66 10-3*63,5 =
0,30 g.
Sulfate de cuivre : électrodes de cuivre. Texte : solution de sulfate de cuivre ( Cu2+aq ; SO42- aq) : concentration c=0,25 mol/L ; volume V= 400 mL = 0,4 L. L'intensité du courant I est constante I=0,5 A pendant la durée Dt= 20 min de l'expérience. 1 F = 9,65 104 C /mol ; M( cuivre) = 63,5 g/mol. Couple oxydant réducteur Cu2+/Cu. Analyse : Question relative à l'équation de la réaction. A la cathode négative, réduction de Cu2+(aq) suivant : Cu2+(aq) + 2e- = Cu(s) cathode A l'anode positive oxydation du métal de l'électrode : ( la masse de l'anode diminue donc) Cu(s ) anode = Cu2+(aq) + 2e- Bilan : Cu2+(aq) +Cu(s ) anode = Cu2+(aq) +Cu(s) cathode Tout se passe comme s'il y avait transfert du cuivre de l'anode ( dite "soluble") à la cathode. Question relative à la quantité de matière d'électrons. Q= I Dt avec Dt = 20*60 = 1200 s. Q = 0,5*1200 = 600 C. Or Q = 96500 n(e-) d'où n(e-) =600/96500 =6,22 10-3 mol. Question relative à la variation de masse de l'anode. A l'anode positive oxydation du métal de l'électrode : ( la masse de l'anode diminue donc) Cu(s ) anode = Cu2+(aq) + 2e- n(Cu(s ) anode) = ½ n(e-) =0,5*6,22 10-3 = 3,11 10-3 mol. masse g) = quantité de matière (mol) * masse molaire (g/mol) m = 3,11 10-3*63,5 = 0,197 g.
|
||||||||
|
|
||||||||
|
|