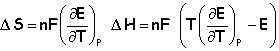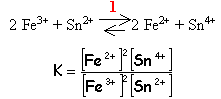révisions lycée
|
|
|
|
Une réaction
d'oxydo-réduction correspond à un
transfert
d'électrons
entre la forme réduite
red2
d'un couple
redox
(red2
/
ox2) vers
la forme
ox1
d'un autre
couple
redox(red1
/
ox1)
selon le bilan : n1
red2
+
n2
ox1
--->
n2
red1
+
n1
ox2 dans ce bilan
les électrons échangés
n'apparaissent plus.
2 fois
{
8H+ +
MnO4-
+ 5e- ---> Mn2+ +
4
H2O.
}
réduction 5 fois
{
H2C2O4
---> 2 CO2 + 2H+ +
2e-.}
oxydation 5
H2C2O4
+
16H+ + 2
MnO4-
+
10e-
---> 2 Mn2+ + 8 H2O + 10
CO2 + 10
H+ +
10
e- 5
H2C2O4
++
6 H+ + 2
MnO4- ---> 2
Mn2+ + 8 H2O + 10
CO2 exemple de l'ion manganate
MnO42- en milieu
neutre. 3
MnO42- + 2 H2O
---> 2MnO4-
+MnO2(solide)
+ 4 OH-
écriture
des réactions
d'oxydo-réduction
exemple
dismutation
Lors d'une oxydation, le n.o d'un élément augmente
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|
|
|
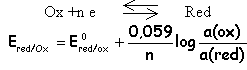
solide ou phase liquide différente de la solution a=1 espèce ionique soluble a voisin c solution diluée espèce gazeuse a=P atm E0 potentiel standart Le potentiel du couple H2/H+ à pH=0 est choisi comme référence. 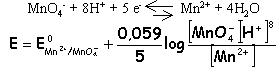
argent entouré de chlorure d'argent solide plongeant dans une solution de KCl
|
F=96500 C ; E f.e.m en V ; A affinité en J. exemple de la pile Zn|ZnSO4 saturée :: Hg2SO4 saturée|Hg à 298 K: E= 1,454 V et dE/dT=-5,5 10-4 VK-1. oxydation du zinc : Zn + SO42- donne ZnSO4 solide + 2e- réduction de l'ion Hg22+ : Hg2SO4 + 2e- donne 2 Hg liquide + SO42- réaction de la pile : Zn + Hg2SO4 donne 2 Hg + ZnSO4
A = 2*96500*1,454 = 280 600 J DS=2*96500*(-5,5 10-4 )= -106,15 JK-1. DH =2*96500*(298(-5,5 10-4) -1,454) = -312 200 J |
|||||
|
Fe3+ : -4,6 ; Fe2+ : -78,9 ; Sn2+ : -27,2 ; Sn4+ : 2,5 déterminer
|
|
|
|
|
|
|
|
|
(1)Pt|H2|H+ 1 molL-1 ::Sn2+ 1 molL-1,Sn4+ 1 molL-1|Pt (2) Sa f.e.m est E= E2-E1= E0 Sn2+/Sn4+. réaction de la pile H2 + Sn4+ équilibre avec 2H+ + Sn2+ n= 2 électrons mis en jeu affinité de cette réaction : A= 2 F E0 Sn2+/Sn4+. A=-(m0Sn2+ + 2m0H+-m0H2- m0Sn4+) = m0Sn4+-m0Sn2+ E0 Sn2+/Sn4+= 0,154 V de même E0 Fe2+/Fe3+= 0,77 V Ecrire l'égalité des potentiels des 2 couples redox 0,154 + 0,0,59/2 log [Sn4+]/[Sn2+] = 0,77 + 0,0,59/2 log [Fe3+]²/[Fe2+]²
0,059/2 log K=0,77-0,154 d'où K=10 21 réaction totale dans le sens 1 |
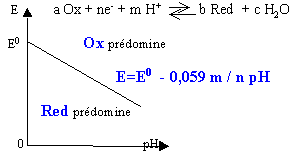
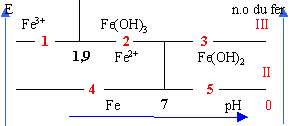
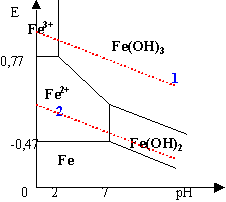
La droite E=f(pH) partage le plan en deux régions |
|
|
|
|
|
droite verticale pH=pKa :intervention d'équilibre acide base |
|
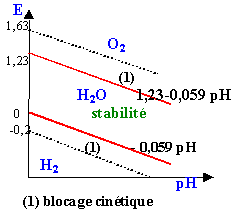 |
zone supérieure : l'eau peut être décomposée avec dégagement de O2 zone inférieure : l'eau peut être décomposée avec dégagement de H2 |
|
E0 Fe/Fe2+=-0,44V ; E0 Fe2+/Fe3+=0,77V à pH=0 pKs1 ( Fe(OH)2(s)=15,1 ; pKs2 ( Fe(OH)3(s)=37,4; |
|||||||||||||||||||||||||||||||||||
|
corrigé |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||