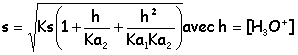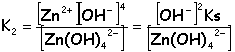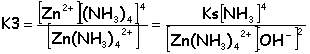|
|
|
|
La dissolution partielle du
composé solide
CmAn
dans l'eau fourni une
solution saturée, siège de
l'équilibre hétérogène
CmAn
solide en
équilibre avec
m
Cn+
+ n
Am-. La loi d'action de masse
s'écrit: Ks =
[Cn+]m
[Am-]n
=
e A/RT
............concentrations
en
molL-1.
A :
affinité chimique Ks est une
constante sans unité, qui ne dépend
que de la
température Le produit des
concentrations
[Cn+]m
[Am-]n
est
inférieur à Ks.
|
|
|
|
La solubilité du chromate d'argent Ag2CrO4, dans l'eau à 25 ° est 0,0027 g par 100 mL. Calculer le produit de solubilité du chromate d'argent.Ag=108; Cr=52; O=16 gmol-1. Ag2CrO4 solide en équilibre avec 2Ag+ + CrO42-. masse molaire Ag2CrO4 :332 gmol-1. ......0,0027/0,1 = 0,027 gL-1 s=[CrO42-] = 0,027/332= 8,13 10-5 mol L-1; [Ag+]=2s ; Ks=[CrO42-] [Ag+]²=4s3= 2,15 10-12. |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Na2SO4 ---> 2 Na+ + SO42- SrSO4 solide en équilibre avec Sr2+ + SO42- s=[Sr2+] ......Ks= [Sr2+] [SO42-]=s (s + 0,1)= 2,818 10-7 La résolution de l'équation du second degré donnne s = 2,8 10-6 mol L-1. Dans l'eau pur la solubilité serait : s²=2,818 10-7 5,3 10-4 mol L-1. |
|
|
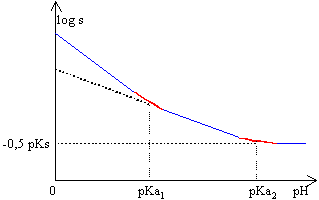
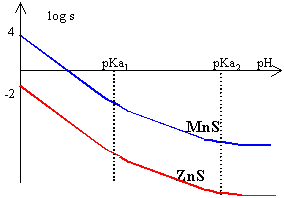
pKa1(CO2,H2O/HCO3-)=6,4; pKa2(HCO3-/CO32-)=10,3
|
|
|
|
|
|
|
|
|
à la dissolution exacte s=0,01/0,1 = 0,1 mol L-1.
0,01= 10-10(1 + h/10-10,3 + h²/10-16,7 ) 10-2= 10-10 + 1,995 h +106,7 h² d'où la concentration finale des ions hydronium 4,45 10-5 mol L-1. pH=4,4 La solution demeure électriquement neutre: 2[Sr2+]+[H3O+]=2[CO32-] + [HCO3-] +[OH-] +[Cl-] à pH 4,4 , inférieur à pKa1 les ions OH- et CO32- et HCO3-sont minoritaires. 2[Sr2+]+[H3O+]= [Cl-] d'où [Cl-] = 0,2 mol L-1. il faut ajouter 0,02 mol de chlorure d'hydrogène dans 0,1 l de solution pour dissoudre exactement le précipité. à pH=8, s=rac. carrée(10-10(1 + 10-8/10-10,3 +10-16/10-16,7 )= 1,43 10-4 mol L-1. |
|
|
K2([Zn(OH)4] 2-) =4,5 10-16. K3([Zn(NH3)4] 2+) =1 10-9.
|
|
|
|
|
|
|
|
|
pH = 14 + log(2,12
10-7)=
7,32.
d'où [OH-]=0,1 mol
L-1 et
pH=13.
La solution est électriquement neutre: 2[Zn2+] +[Na+] + [H3O+] = 2[Zn(OH)4] 2- + [OH-] + 2[SO42-] milieu basique [H3O+]<<[OH-] et [Zn2+]<<[Zn(OH)4] 2- [Na+] =
2[Zn(OH)4] 2- +
[OH-] +
2[SO42-]
; [OH-]
ajouté =
[Na+]=
0,104 mol L-1.
A la dissolution exacte [Zn(NH3)4] 2+ = 10-3 mol L-1; La solution est électriquement neutre: 2[Zn2+] +[NH4+] + [H3O+] + 2[Zn(NH3)4] 2+= [OH-] + 2[SO42-] milieu basique [H3O+]<<[OH-] et [Zn2+]<<[Zn(NH3)4] 2+ [NH4+] + 2[Zn(NH3)4] 2+= [OH-] + 2[SO42-] d'où [NH4+] = [OH-]
constante d'acidité du couple NH4+/NH3: Ka= [NH3][H3O+] /[NH4+] Ka=10-9,26=[NH3]10-14 /([NH4+][OH-]) d'où [NH3]/[OH-]²= 104,74. constante de dissociation du complexe :
d'où [OH-]=3,7 10-3 mol L-1 (pH=14+log3,7 10-3=11,6) et [NH3] = 0,74 mol L-1 NH3 total=0,747 mol |
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|||||||