|
|
|
|
mélange de gaz parfaits On définit la pression partielle Pi et la fraction molaire xi du gaz dans le mélange .
|
|||||||
application
Une bouteille de 20 L contient du
dioxygène, à la pression de 180 bars.
Calculer le nombre de bouteilles de 1 L que l'on
peut remplir, le gaz étant à la
pression atmosphérique et à la
même température.
Qté de matière du gaz :
n=1,8 *2 105
/(RT) pression finale : 105 pascals ;
volume final : V* 10-3 m3 ;
température T Qté de matière du gaz : n =
V*10-3 * 105 /(RT)=
100 V /(RT) 100 V = 1,8 *2 105
d'où V=3600 L
auquel il faut retirer 20L
: 3580
L
pression initiale : 1,8 107 pascals ;
volume initial : 0,02 m3 ;
température T
|
|
|
|
|
b : représente le volume propre de l'ensemble des molécules a : du fait des attractions intermoléculaires et des chocs entre les molécules, la pression réelle exercée sur chaque molécule est supérieur à P. |
n : Qté de matière du gaz mol P : pression extérieure imposée pascal T : température K |
- Calculer le travail reçu par n moles de gaz parfait lors d'une transformation isotherme, réversible le faisant passer de l'état (P0, V0) à l'état (P1, V1).
- Même question pour une mole de gaz réel.
- Même question pour une transformation adiabatique, faisant passer une mole de l'état (P0, V0, T) à l'état (P1, V1,T1).
PV=nRT conduit à P0V0=P1V1
travail élémentaire
dW= - PdV= -nRT dV/ V=-nRT d(lnV)
W = -nRT ln(V1/V0)
l'équation de Wan der Waals donne P = RT/(V-b) -a dV/V²
on intègre à température constante.
W=-RTln((V1-b)/(V0-b)
+
a(1/V1-1/V0)
adiabatique:
pas d'échange de chaleur
PVg=Cte
dW= - PdV
P = P0V0g /V g.
dW=-P0V0g dV/V g. on intègre
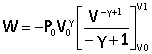
|
ne dépendent que de la température dU=Cv dT .........Cv : capacité thermique à volume constant JK-1 dH=Cp dT.........Cp : capacité thermique à pression constante JK-1 Cp et Cv dépendent en général de la température Cp-Cv = nR et Cp/Cv = g (g=1,4 pour un gaz parfait diatomique, dépend de la température) (g=5/3
pour un gaz parfait monoatomique,
indépendant de la température)
dS=dQ/T avec dQ=Cv dT+ PdV = Cp dT- VdP |
|
|
application Une masse m de gaz parfait subit le cycle de transformations réversibles suivantes
corrigé |
|
|
en A : P1, V1=10 L; T=300K isotherme de C à A :
P2V2=P1V1
d'où P2=
5
105
Pa
WAB =-P1DV= 105(2-10)10-3= 800 J WBC = 0 isochore dWCA = -PdV=-nRT1 dV/ V WCA
=-nRT1ln( V1/V2)=
-P1V1ln(5)=-105*210-3ln5=
-1610
J
l'énergie interne ne varie pas sur le cycle W+Q=0 d'où SQ=-SW= 810 J l'énergie interne ne varie sur l'isotherme: QCA=-WCA= 1610J QAB= CpDT (isochore) = Cp(TB-T1) calcul TB: P1V2=nRTB; P1V1=nRT1 d'où TB=V2T1/V1= 60K QAB= 11,66(60-300)=-2800J 810= -2800+1610+QBC d'où QBC = 2000J |
|
|
|
|
|
Un récipient indéformable, cylindrique, fermé à ses 2 extrémités est divisé en 2 parties par un piston mobile sans frottement et conducteur de la chaleur. Les parois du récipient sont imperméables à la chaleur. Les 2 compartiments contiennent de l'air,initialement:
Le piston abandonné à lui même atteind une position d'équilibre. Déterminer la pression et la température finales ainsi que la variation d'entropie. |
|
|
|
|
|
|
|
|
A l'équilibre, pression P et température T sont les mêmes dans chaque compatiment. Soient V'1 et V'2 les volumes finaux des compartiments. P1V1/T1 = PV'1/T et P2V2/T2 = PV'2/T et V'1+V'2=V1+V2. La variation DU d'énergie interne du gaz est nulle :
T=(n1T1+
n2T2)/(n1+n2)=
300K
n1+n2 = P1V1/(RT1) + P2V2/(RT2) = P(V'1+V'2)/(RT) P=
1,5 bars
dS=n(Cp dT/t - V/T dP) dS=n Cp dln(T) -nR dln(P) DS1= n1Cp ln(T/T1)- n1R ln(P/P1) calcul Cp Cp/Cv=1,4 et Cp-Cv=nR d'où Cp= nR/(1-1/1,4)=3,49 JK-1. DStotal = 0,056 JK-1. |
|
retour - menu