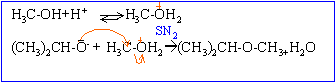voir le match : l'essentiel du cours
|
|
|
|
|
|
corrigé
L'alcool A réagit avec le sodium en donnant un alcoolate, base plus forte que l'eau.
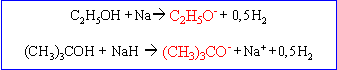
Un alcool tertiaire réagit rapidement avec HCl (test de Lucas)

B est un dérivé chloré de masse molaire M=29 *3,2 =92,8 gmol-1.
soit x le nombre d'atomes de chlore dans B:
35,5x / 38,4 = 93 /100 d'où x=1
masse molaire de la chaine hydrocarbonée dans B: 92,8-35,5 = 57,3
soit C4H9Cl.
A étant de plus un alcool tertiaire :
(CH3)3 C-OH 2-méthylpropan-2-ol
|
|
corrigé
dosage acide base : RCOOH + HO- --> RCOO- + H2O
A l'équivalence , qté de matière de soude = qté de matière d'acide
20 10-3 * 0,5 = 10-2 mol
masse molaire de l'acide : 0,6/ 10-2 = 60 gmol-1.
D est l'acide éthanoïque.
A est un ester , éthanoate de.....; B un alcool.
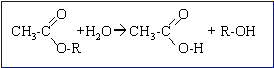
soit M , la masse molaire de l'alcool; celle de l'ester est: M+60-18=M+42
une mole d'ester donne une mole d'alcool d'où :
16,4 / (M+42)= 12,2 / M
La masse molaire de l'alcool est 122 g mol-1.
La déshydratation de cet alcool donne un hydrocarbure éthylénique dont l'oxydation donne, entre autre, de l'acide benzoique C6H5CO2H.
alcools possibles: C6H5-CH2-CH2OH ou C6H5-CHOH-CH3.
seul le second possède un carbone asymétrique : molécule chirale.
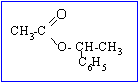 A
: éthanoate de
1-phényléthyle
A
: éthanoate de
1-phényléthyle
|
|
|
|
|
|
|
On ajoute alors en excès une solution d'iodure de potassium. Pour décolorer le diiode libéré, il faut ajouter 12 mL de thiosulfate de potassium à 0,5 molL-1.
|
corrigé
oxydation de l'alcool en acide éthanoïque.
5 C2H5OH + 4 MnO4- + 12H+ --> 5 CH3CO2H + 4 Mn2+ + 11 H2O
réduction du permanganate en excès:
2 MnO4- + 10 I- + 16H+ --> 2 Mn2+ + 5 I2 + 8 H2O
dosage du diiode formé:
2 S2O32- + I2 --> S4O62- + 2I-
Qté de matière
initiale permanganate : 0,05*0,1= 0,005 mol.
thiosulfate: 0,012*0,5= 0,006 mol
diiode : 0,006 / 2 = 0,003 mol
permanganate en excès: 0,003*2/5= 0,0012 mol
permanganate ayant oxydé l'alcool: 0,005-0,0012 = =0,0038 mol
alcool dans S: 0,0038*5/4= 0,00475 mol
dans le distillat :0,0475 mol
soit 0,0475/ 0,020= 2,37 mol L-1 d'alcool.
degré du vin :
2,37*100 = 237 mol d'alcool dans 100L de vin
237*46= 10,902 kg d'alcool
10,902/790=0,0138 m3 =13,8 L ou 13,8°.
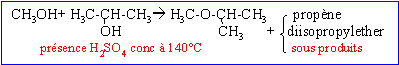
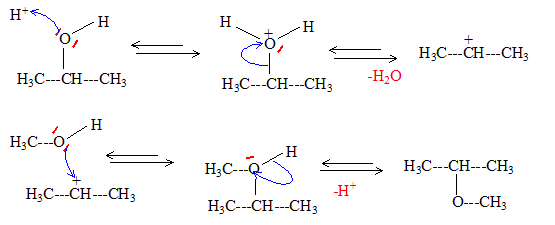
A: alcoolate alcalin (CH3)2CHOH+ Na-->(CH3)2CHO- + Na+ +0,5H2. B: alcool protoné; H2O est un meilleur groupe partant que OH-.
réaction concurrente: formation d'un alcène. Autre mécanisme : formation du carbocation isopropylique, réaction sur le méthanol et enfin perte du proton de l'oxonium formé.
|
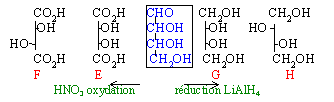
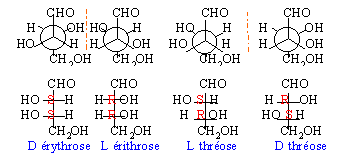
Deux isomères A et B ont pour formule brute C4H8O4. Les molécules A et B sont chirales. Ce sont des réducteurs vis à vis du nitrate d'argent ammoniacal. Traités à chaud par l'anhydride éthanoïque ils donnent C et D de formule brute C10H14O7. Donner les formules semi-développées de A et B. L'oxydation par l'acide nitrique de A et B conduit à des diacides notés E et F de formule brute C4H6O6.La réduction de A et b donne G et H de formule brute C4H10O4. E et G issus de A ne sont pas chirales alors que F et H issus de B le sont. Identifier A et B. Donner les représentation de Newmann et Fischer de A et B. Préciser la nomenclature D ou L .
corrigé
propriété réductrice : donc groupe aldehyde en bout de chaine
formation d'un triester : (passage de 4 à 10 carbones soit 3 groupes H3C-CO-)
donc 3 fonctions alcools
HO-CH2-C*HOH-C*HOH-CHO
deux carbones asymétriques soit 4 stéréoisomères