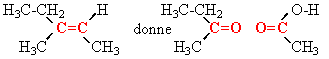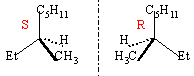|
les
alcènes sup
|
les
alcynes (quiz et exercices
corrigés)
|
|
|
|
1
|
composition
d'un mélange
|
|
La combustion complète de 40 mL d'un
mélange de propane et de propène a
nécessité 192,5 mL de
dioxygène. Quelle est la composition
centésimale en volume du mélange
?
|
corrigé
C3H8 + 5 O2 --> 3
CO2 + 4 H2O
C3H6 + 4,5 O2 --> 3
CO2 + 3 H2O
On appelle x le volume (mL) de
propane et y (mL) celui de propène
x + y = 40
(1)
les réactifs étant
gazeux on peut interpréter les équations bilan
en volume
5 x + 4,5 y = 192,5
(2)
la résolution de ces 2
équations donne : 15 mL de propane et 25 mL de
propène
15/40*100 =
37,5
% de propane en volume 62,5 % de
propène
|
|
|
|
2
|
densité
d'un mélange gazeux par rapport à
O2
|
|
La densité par rapport au
dioxygène d'un mélange
d'éthylène et de propène est
1,06. Quelle est la composition centésimale
en volume du mélange ? C=12 ; H=1 ; O=16
gmol-1 . V=22,4 L
mol-1.
|
corrigé
masse de 22 400 mL (1 mole) du
mélange : 1,06*32= 33,6 g
22 400 mL d'éthylène
pèsent : 28 g
100 mL de mélange
pèsent : 33,6*100/ 22 400
soit
x
le volume d'éthylène et
y
le volume de propène dans 100 mL de mélange
x
+
y
=
100 (1)
x
mL d'éthylène C2H4
pèsent :
28x
/22 400 g
22 400 mL de propène
C3H6 pèsent : 42 g
y
mL de propène pèsent : 42
y
/22 400 g
28
x
/22 400 +
42y
/22 400 = 33,6*100/ 22 400
28
x
+
42y
=
33,6*100
(2)
la résolution des 2
équations donne : 60%
éthylène et 40% propène
|
|
|
|
3
|
ozonolyse
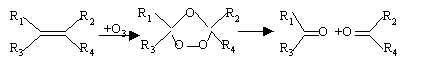
|
|
On traite 0,1 mole d'un carbure
éthylènique A par l'air
ozonisé ; on obtient 0,1 mole
d'acétone et 0,1 mol d'éthanal.
Identifier A
|
corrigé
A compte une seule double liaison ,
car on obtient 2 produits
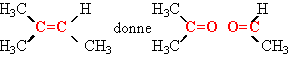
2-méthylbut-2-ène
|
|
|
4
|
oxydation par
KMnO4 concentré à chaud
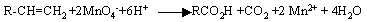
|
La combustion complète de 10 mL d'un
hydrocarbure A a nécessité 90 mL de
O2 et a donné 60 mL de CO2
dans des conditions telles que
réactifs et produits soient des gaz. A
réagit avec une solution de permanganate de
potassium concentrée à chaud et donne
de la butanone et de l'acide éthanoique .
Identifier A.
corrigé
A est un alcène
comptant une seule double liaison
CnH2n + 1,5 n O2
--> n CO2 + n
H2O
|
alcène
|
dioxygène
|
dioxyde de carbone
|
|
1
|
1,5 n
|
n
|
|
10
|
90
|
60
|
d'où n = 6
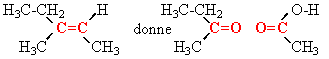
(Z) 2-méthylpent-2-ène ou
l'isomère (E)
|
|
|
|
5
|
réactions
d'addition ( Br2 et HBr)
|
1,68 g d'un alcène A fixe 2,4 g de dibrome .
A traité par HBr donne le même produit qu'on
opère en présence ou en l'absence de peroxyde.
Identifier A.
corrigé
Les 2 atomes de carbone de la double liaison portent les
mêmes groupes; sinon lors de l'addition de HBr on
obtiendrait des produits différents :
en l'absence de peroxyde : Br se fixerait surle carbone
de la double liaison le plus substitué (règle
de Markownikov)
en présence de peroxyde : Br de fixerait sur le
carbone le moins substitué
CnH2n + Br2
-->CnH2nBr2
une mole d'alcène réagit avec une mole de
dibrome
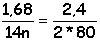
d'où
n = 8
|
|
|
6
|
combustion
d'hydrocarbures
|
Un mélange
d'hydrogène, de méthane et de
pentène occupe un volume de 80 mL. on
l'introduit dans un eudiomètre avec 250 mL
d'oxygène. Après combustion, les gaz
occupent un volume de 165 mL dont 110 ml sont
absorbables par la potasse et le reste est
absorbable par le phosphore.
- Ecrire les 3
équations bilan
- Sachant que
les volumes gazeux sont mesurés dans les
mêmes conditions de température et
de pression, quelle est la composition du
mélange?
corrigé
H2 +
0,5
O2 --> H2O
CH4 +
2
O2 --> CO2 +
2H2O
C5H10
+
7,5
O2 -->
5
CO2 + 5 H2O
La potasse absorbe le
dioxyde de carbone et le phosphore absorbe le
dioxygène ( ce dernier était en
excès de 55 mL soit 195 mL O2
utile)
L'eau se condense
quand le système revient à
température ambiante
x:
volume dihydrogène;
y
volume méthane;
z
volume pentène
x
+
y
+
z
= 80
0,5x
+
2
y
+
7,5
z
= 195
y
+5
z
= 110
La résolution de ce
système donne :
50
mL H2 ; 10 mL CH4 ; 20 mL
C5H10
|
|
7
|
hydratation
du Z but-2-ène et du
2-méthylpropène
|
- Préciser
les conditions
expérimentales.
- Ecrire les
équations des
réactions.
- Préciser
les configurations des
produits.
corrigé
action d'une solution d'acide sulfurique
à 10% en masse vers 50°C.
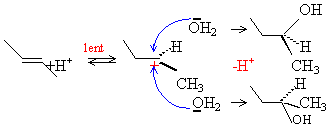
le carbocation étant plan, on obtient un
mélange racémique (50% isomère
S et 50 % isomère R)
A partir du 2-méthylpropène on
obtient l'alcool le plus substitué
(règle de Markownikov) c'est à dire
le 2-méthylpropan-2-ol.
|
8
|
identifier
quelques hydrocarbures
|
- Un
hydrocarbure A
(C9H16) conduit,
par hydrogénation à B
(C9H20).
- L'ozonolyse
de A donne un mélange de 3
composés : C
(C4H8O);
D
(C3H6O);
E
(C2H2O2).
D et E
réduisent la liqueur de Fehling
et l'ion diammine argent tandis que C
ne réagit pas dans ces
conditions.
- L'oxydation
de D et E conduisent à des
acides, respectivement
:F(C3H6O2)
et
G(C2H2O4)
- La
réduction de C au moyen de
LiAlH4 fournit H
(C4H10O).
La
déshydratation de H au moyen de
H2SO4 donne 3
hydrocarbures I,J,K, isomères
C4H8.
Identifier
tous les composés.
corrigé
A possède
2 double liaisons : une mole de A donne
par ozonolyse 3
composés.
D et E sont des
aldehydes réducteurs.
D et E s'oxydent
en acides carboxyliques .
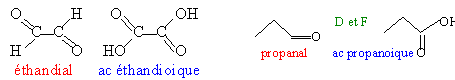
C est une
cétone réduite en alcool par
LiAlH4. L'alcool est
déshydraté en
alcène.
but-1-ène
; Z et E but-2-ène;
méthylpropène.
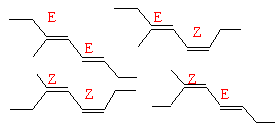
les isomères de A
les isomères de B
C9H20 :
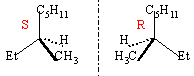
retour
- menu
- menu
|
|
|
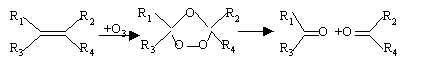
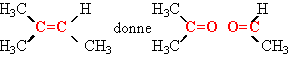
![]()
![]()