classification électrochimique
|
|
|
|
prévisions des réactions redox lycée
fiche: ce qu'il faut retenir (quiz)
un atome, ion ou molécule qui peut gagner des électrons est un oxydant
l'oxydant se réduit :
la réaction est une réduction
un atome, ion ou molécule qui peut perdre des électrons est un réducteur
le réducteur s'oxyde
la réaction est une oxydation
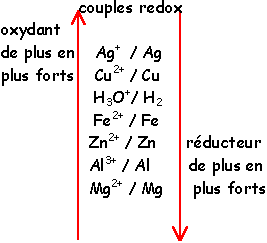
Entre deux couples redox, une réaction naturelle se produit entre le réducteur le plus fort et l'oxydant le plus fort
|
|
|
|
A une masse m=2 g de zinc on ajout V=600 mL d'une solution d'acide chlorhydrique telle que la concentration soit C=0,5 mol L-1.Zn=65,4; H=1 ;Cl=35,5 g mol-1. volume molaire 22,4 L mol-1.
- Quelles sont les quantité de matière initiale de chaque réactif?
- En déduire qui est en excès et de combien?
- Quels sont les concentrations finales des ions?
- Vérifier que la solution est électriquement neutre.
- Quels sont la masse et le volume de dihydrogéne formé ?
- Quelle est la quantité d'électricité mise en jeu ?
corrigé
Une réaction naturelle a lieu entre le réducteur le plus fort Zn et l'oxydant le plus fort H3O+
Zn + 2 H3O+ donne Zn2+ + H2+ 2H2O
H3O+ / H2
Zn2+ /Zn
|
|
|
|
|
|
|
au départ |
3,06 10-2 |
0,3 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
concentration mol
L-1
la solution reste électriquement
neutre
[H3O+]+2[Zn2+]=[Cl-]
volume de dihydrogène:
3,06 10-2 *22,4 =0,685 L
Quantité d'électricité mise en jeu
Zn s'oxyde et donne Zn2+ + 2 électrons
la quantité de matière d'électrons (mol)est deux fois plus grande que celle de zinc
2*3,06 10-2=6,12 10-2 mol
la charge d'une mole d'électrons est 96500 coulombs ou 1 faraday
96500*6,12 10-2=5906 C
A une masse m=2 g d'aluminium on ajout V=50 mL d'une solution d'acide sulfurique telle que la concentration en ion hydronium soit C=0,4 mol L-1.Al=27; H=1 ;S=32 ; O=16 g mol-1. volume molaire 22,4 L mol-1.
- Quelles sont les quantité de matière initiale de chaque réactif?
- En déduire qui est en excès et de combien?
- Quels sont les concentrations finales des ions?
- Vérifier que la solution est électriquement neutre.
- Quels sont la masse et le volume de dihydrogéne formé ?
- Quelle est la quantité d'électricité mise en jeu ?
corrigé
Al + 3 H3O+ donne Al3+ + 1,5H2+ 3H2O
H3O+ / H2
Al3+ /Al
|
|
|
|
|
|
|
au départ |
7,41 10-2 |
0,02 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
concentration mol
L-1
la solution reste électriquement
neutre
3[Al3+]=2[SO42-]
volume de dihydrogène:
10-2 *22,4 =0,224 L
Quantité d'électricité mise en jeu
Al s'oxyde et donne Al3+ + 3 électrons
la quantité de matière d'électrons (mol)est trois fois plus grande que celle d'aluminium ayant réagi
3*6,67 10-3=2 10-2 mol
la charge d'une mole d'électrons est 96500 coulombs ou 1 faraday
96500*2 10-2=1930 C
d'autre données m=1 g; V=100 mL; C= 1 mol L-1....
réponses: ion hydronium excés de 8,9 10-2 mol;
[Al3+]=0,37 mol L-1 ; gaz 5,56 10-2 mol ; 10700 C
A une masse m=10 g d'un mélange aluminium et cuivre on ajoute une solution diluée d'acide sulfurique en excès. On recueille V=3,36 L de dihydrogène .
Al=27; H=1 ;S=32 ; O=16 ; Cu=63,5 g mol-1. volume molaire 22,4 L mol-1.
- Quelle est la quantité de matière de dihydrogéne?
- Ecrire l'équation bilan
- En déduire la qté de matière d'aluminium ayant réagi
- En déduire la masse d'aluminium
- Quelle est la composition du mélange en % massique.
corrigé
Al + 3 H3O+ donne Al3+ + 1,5H2+ 3H2O
Cu2+ / Cu
H3O+ / H2
Al3+ /Al
|
|
|
|
|
|
|
|
masse molaire fois qté de matière en mol =27 *0,1 =2,7 g
je déduis la masse de cuivre : 10-2,7 =7,3 g
% massique
2,7 /10 *100= 27 % aluminium
7,3 /10 *100= 73 % cuivre
autre données : m=20 g V=2,016 L
...réponses
0,09 mol H2 ; 8,1 % Al
A une masse m=8,2 g d'un mélange aluminium et fer on ajoute une solution diluée d'acide sulfurique en excès. On recueille V=7,84 L de dihydrogène . On notera x la quantité de matière de fer en mol et y celle d'aluminium.
Al=27; H=1 ;S=32 ; O=16 ; Fe=56 g mol-1. volume molaire 22,4 L mol-1.
- Quelle est la quantité de matière de dihydrogéne?
- Ecrire les équations bilan
- En déduire une 1 ère relation entre x et y et la quantité de dihydrogéne en mol.
- Ecrire une autre relation entre x et y et la masse du mélange
- Quelle est la composition du mélange en % massique.
corrigé
Al + 3 H3O+ donne Al3+ + 1,5H2+ 3H2O
Fe + 2 H3O+ donne Fe2+ + 1H2+ 2H2O
H3O+ / H2
Fe2+ / Fe
Al3+ /Al
volume du gaz divisé par le volume molaire = 7,84 /22,4 =0,35 mol
Qté de dihydrogéne issue de la 1ère réaction : 1,5 y mol
Qté de dihydrogéne issue de la 2ème réaction : x mol
d'où x + 1,5 y = 0,35
masse du mélange = somme des masses de fer et d'aluminium
masse = masse molaire fois qté de matière en mol
masse de fer :56 x
masse d'aluminium :27 y
d'où 56 x + 27 y = 8,2
la résolution du système de 2 équations à 2 inconnues donne:
aluminium 5,4 g ou 0,2 mol ou 65,9 % en masse
fer 2,8 g ou 0,05 mol ou 34,1 % en masse
d'autre
données m=13,7
; V=12,32 L.......réponses:5,6
g fer 8,1 g Al
A une masse m=12,7 g dcuivre on ajoute V=0,3 L d'une solution d'acide nitrique (C=2 mol L-1) .
Cu=63,5; H=1 ;N=14 ; O=16 g mol-1. volume molaire 22,4 L mol-1.
- Quelles sont les quantité de matière initiale de chaque réactif?
- Ecrire l'équation bilan
- En déduire qui est en excès et de combien?
- Quels sont les concentrations finales des ions?
- Vérifier que la solution est électriquement neutre.
- Quels sont la masse et le volume de monoxyde d'azote formé ?
- Quelle est la quantité d'électricité mise en jeu ?
corrigé
2 fois{ NO3- + 4 H++ 3 électrons donne NO + 4 H2O }
3 fois{ Cu donne Cu2+ +2 électrons }
dans le bilan les électrons n'apparaissent pas
2NO3- + 8 H++ 3Cu donne 3 Cu2++2NO + 8 H2O
NO3- / NO
Cu2+ / Cu
|
|
|
|
|
|
|
|
au départ |
0,2 |
0,6 |
|
0,6 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
concentration mol
L-1
la solution reste électriquement
neutre
2[Cu2+] + [H3O+]=[NO3-]
volume de monoyde d'azote:
0,133 *22,4 =2,98 L
Quantité d'électricité mise en jeu
Cu s'oxyde et donne Cu2+ + 2 électrons
la quantité de matière d'électrons (mol)est deux fois plus grande que celle de cuivre ayant réagi
2*0,2=0,4 mol
la charge d'une mole d'électrons est 96500 coulombs ou 1 faraday
96500*0,4=38600 C
d'autre données.....m=6,35 g ; V=100 mL ; C=2 mol L-1 ;
réponses:
Cu en excès de 0,025 mol ; Cu2+ 0,75 mol L-1 ; 1,12 L de gaz ; 0,15 mol électrons
On a un mélange sous forme de poudre de cuivre, de zinc et d'aluminium. On ajoute de l'acide chlorhydrique en excès à 10,5 g de ce mélange. Après réaction, il reste un résidu solide de 2,4 g et le gaz qui s'est dégagé lors de l'attaque par l'acide occupe un volume de 5,66 L.
- Calculer la composition du mélange en pourcentage massique.
Cu=63,5 ; Al=27 ; Zn=65,4 g mol-1 . volume molaire : 22,4 L mol-1.
corrigé
Le cuivre n'est pas attaqué dans ces conditions : les 2,4 g résiduels correspondent à la masse de cuivre soit 2,4*100/10,5 = 22,8%
Zn + 2 H3O+ donnent Zn2+ + H2 + 2H2O
Al + 3 H3O+ donnent Al3+ + 1,5 H2 + 3H2O
a mol de zinc et b mol d'aluminium
masse (g) = qté de matière (mol) * masse molaire (gmol-1)
masse mélange (10,5-2,4)= masse zinc + masse aluminium
8,1 =
a
*65,4 +
b
*27 (1)
qté
de matière (mol)=
volume (L)
/ volume
molaire (Lmol-1)
5,66/22,4 =0,253 = a + 1,5 b (2)
la résolution du système de 2 équations donne a=0,076 mol et b=0,118 mol
soit en masse: 4,97 g de zinc ou 47,2% et 3,18 g Al ou 30,8%
Un alliage contient du bismuth, de l'étain et du plomb. Il fond à 95°C. Une masse m=5 g de cet alliage est traité avec V=100 mL d'acide chlorhydrique à C=3 mol L-1. Le résidu solide a une masse de 2,4 g et on recueille 0,372 de gaz.
On recueille 10 mL de la solution décantée dans laquelle on ajoute un excès d'ion iodure: On obtient un précipité jaune PbI2 de masse 0,345 g
masse atomique molaire en g mol -1 : Pb=207 ; I= 127 ; Sn=118,7 ;
volume molaire 22,4 L mol-1
- Ecrire les équations bilan
- exprimer les quantités de matière initiales en mol
- interpreter les équations bilan et en déduire la composition massique de cet alliage.
corrigé
Pb + 2 H3O+ donne Pb2+ + H2+ 2H2O
Sn + 2 H3O+ donne Sn2+ + 1H2+ 2H2O
Bi3+ / Bi
H3O+ / H2
Pb2+ /Pb
Sn2+ /Sn
le résidu solide est du bismuth 2,4g soit 48% en masse
Pb 2++ 2 I- donne Pb I2 solide
masse molaire Pb I2 207+2*127=461 g mol-1.
Qté de matière Pb I20,345/ 461=7,48 10-4 mol
7,48 10-4 mol dans le dixième de la solution
j'en déduis donc 7,48 10-3 mol de plomb où 7,48 10-3*207=1,55g de plomb ..31%
à partir de
7,48 10-3
mol de plomb j'obtiens
7,48 10-3
mol de dihydrogène
soit 7,48 10-3 *22,4 =0,1675 L
le volume de dihydrogène issu de l'attaque due l'étain est donc :
0,372-0,1675=0,204 L soit 0,204 / 22,4 =9,12 10-3 mol H2.
9,12 10-3 mol H2 proviennent de l'attaque de9,12 10-3 mol d'étain
soit en masse 9,12 10-3 *118,7=1,07 g ou 21,5% étain
je vérifie que la somme des pourcentages est voisine de 100%.
|
|
|
|
|
|
Cu2+ (oxydant) + 2e- ---> Cu réduction Zn + Cu2+ --->Zn2+ + Cu oxydoréduction à partir de (0,02*0,05= 10-3 mol) Cu2+ , 10-3 mol de zinc est oxydé soit 65,4 mg. 10-3 mol de cuivre se dépose soit 63,5 mg. Cu (réducteur) ---> Cu2+ + 2e- oxydation 2Ag+ (oxydant) + 2e- ---> 2Ag réduction Cu + 2Ag+ --->Cu2+ + 2Ag oxydoréduction à partir de (0,005*0,2= 10-3 mol) Ag+ , 10-3 mol d'argent métal peut être réduit soit 108 mg. Donc le cuivre est en défaut. 0,045/108= 4,16 10-4 mol d'argent se dépose soit 2,08 10-4 mol de cuivre et d'ion Cu2+. [Cu2+]=2,08 10-4 /0,2= 1,04 10-3 molL-1 [Ag+]= (10-3- 4,16 10-4 )/0,2= 2,92 10-3 molL-1 [NO3-]= 5*10-3 mol.L-1 [NO3-] = [Ag+] + 2 [Cu2+] 5*10-3 =2,92 10-3 +2*1,04 10-3 vrai |
|
|
|
|
|
Un moyen commode de préparer rapidement une petite quantité de dichlore gazeux consiste à verser une solution concentrée d'acide chlorhydrique sur des cristaux de permanganate de potassium KMnO4. Mn=55; K=39; O=16 gmol-1. V=22,4 Lmol-1.
5 fois { 2 Cl- ---> Cl2 + 2e- } oxydation 2 MnO4- + 16 H+ + 10 Cl- ---> 5Cl2 + 2Mn2+ + 8H2O oxydo-réduction
Qté de matière KMnO4. 25/(39+55+4*16)= 0,158 mol 2,5 mol de dichlore à partir d'une mole KMnO4. 2,5*0,158 = 0,395 mol Cl2 ou 0,395
*22,4 = 8,8
L
8 mol d'ion H+ à partir d'une mole KMnO4. 8*0,158 = 1,27 mol d'ion H+ 1,27 = volume (L)*12 V= 0,105
L
1 mol d'ion Mn2+ à partir d'une mole KMnO4 0,158 mol dans 0,105 litre [Mn2+] = 0,158/0,105= 1,5 mol L-1 |
|