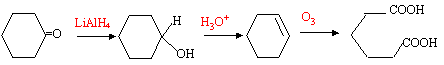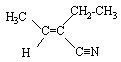|
|
|
corrigé le spectre A le plus dépouillé correspond à l'hexane ( pics vers 3000 cm-1 : élongation des liaisons C-H) le spectre B correspond à l'hexanol ( pic large vers vers 3400 cm-1: élongation des liaisons O-H associées par liaisons hydrogène) le spectre E correspond à l'acide hexanoïque : ( pic large vers vers 3400 cm-1: élongation des liaisons O-H associées par liaisons hydrogène) (pic vers 1715 cm-1 : élongation de la liaison C=O) le spectre D correspond à l'hexanal (pic vers 1715 cm-1 : élongation de la liaison C=O) le spectre C correspond donc à l'ester.
l'ozonolyse donne un seul produit D, donc A possède un cycle la réduction d'une cétone par LiAlH4 donne un alcool ; ce dernier est déshydraté par l'acide sulfurique et donne un alcène. L'ozonolyse de l'alcène conduit à un diacide carboxylique.
cétone : pic à 1720 cm-1 (C=O) alcène : pics à 1640 cm-1 (C=C ) et à 3060 cm-1 ( proton vinylique) acide :
bande large vers 3300 cm-1 ( OH) et à 1730
cm-1 ( C=0)
IR : 1700 cm-1 et 1200 cm-1 pics caractéristiques d'un ester. RMN : triplet à 1,5 ppm ( 3 protons); quadruplet à 4,2 ppm (2 protons); caractérise le groupe -CH2-CH3 déblindé par l'atome d'oxygène; singulet à 8 ppm ( 1 proton) caractéristique d'un proton lié au groupe H-COO H-COO-CH2-CH3
|
|
composé de formule brute C6H9N : bandes IR caractéristiques à 2224, 1640, 840 cm-1. transition UV à 209 nm de forte intensité. RMN : triplet à 1,08 ppm, quadruplet à 2,05 ppm, doublet à 1,85 ppm et quadruplet à 6,3 ppm dans les rapport d'intensité 3 / 2 / 3 / 1. Ces deux derniers groupes sont en fait plus complexes. Quelle est la formule semi-développées de ce composé ? corrigé dbe : ½(6*2+2+1-9) = 3 sites d'insaturation ( 3 doubles liaisons, ou une liaison double et une liaison triple ou bien un cycle et deux liaisons doubles par exemple) IR : bande à 2224 cm-1 : soit une liaison triple carbone carbone ou carbone azote. bande à 1640 cm-1 : liaison double carbone carbone bande à 840 cm-1 : dC-H d'un éthylénique trisubstitué UV : indique une structure conjuguée RMN : d = 1,08 ; m/i = 3/3 et d= 2,05 ppm ; m/i = 4/2 : groupe -CH2-CH3 déblindé de 0,7 ppm soit par un héteroatome soit par une liaison double C=C d = 1,85 ; m/i = 2/3 et d= 6,3 ppm ; m/i = 4/1 : caractérise le groupe =CH(CH3)
|
|
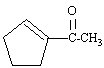
bande IR caractéristique à 2224 cm-1. transition UV à 225 nm de forte intensité. RMN : singulet à 8 ppm ( 3 protons), singulet à 4,3 ppm ( 1 proton), multiplet à 7,8 ppm ( 6 protons) spectre de masse ( abondance relative) : pics à 82 (100) ; 110 (40) ; 28 (45) ; 39 (40) ; 43 (20) ; 67 (10) ; 95 (10) Quelle est la formule semi-développées de ce composé ? corrigé spectre de masse : M=110 g/mol ( sans doute 7 cabone) perte facile de CH3 : pic à 95 perte facile de CO : pic à 82 (110-28) pic à 28 : CO ; pic à 43 : CH3-CO et à 67 (110-43) spectre UV : forte absorption à 225 nm : donc une structure conjuguée ( CO avec une liaison double C=C par exemple) spectre IR : confirme la possibilité d'une cétone conjuguée RMN : singulet (3 protons à 1,95 ppm) : CH3-CO. 1 proton vinylique à 4,3 ppm 6 protons de type alcane : multiplet à 7,8 ppm. C7H10O : dbe : ½(7*2+2-10) = 3 insaturations structure
possible :
|
|
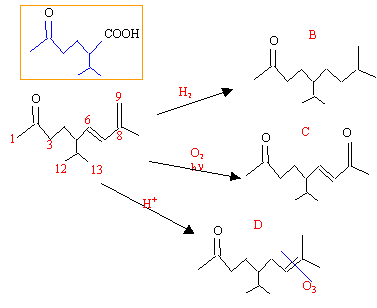
Le composé A , C13 H22 O forme une semicarbazone et donne un teste positif à l'iodoforme. La réduction catalytique ( Pd dans le méthanol ) de A donne B, C13H26O, qui donne également une semicarbazone et un test positif à l'iodoforme. Irradié dans l'air en lumière UV, A est oxydé en C, C12H20O2 qui donne deux moles d'iodoforme lorsqu'il est traité par l'hypoiodite de sodium. L'isomérie en milieu acide de A donne D qui fournit de l'acétone par ozonolyse. Le traitement de A par CrO3 dans l'acide acétique donne l'acide 2-isopropyl-5-oxo- hexanoïque IR : 1718, 1608, 1380, 970 cm-1. UV : forte absorbtion vers 230 nm. RMN : doublet à 0,9 ppm ( 6 protons) ; singulet à 1,8 ppm ( 3 protons) ; singulet à 2 ppm ( 3 protons) ; singulet à 4,85 ppm ( 2 protons) ; doublet de doublet à 5,43 ppm ( 1 proton) ; doublet à 5,93 ppm ( 1 proton ) spectre de masse : 43 ( 100) ; 58 ( 4,5) ; 123 ( 6) ; 136 (8,1) ; 151 ( 16,2) et 194 ( 9,8) Donner les structures des produits de A à D. corrigé présence de CH3-CO dans A ( formation de semi carbazone et test à l'iodoforme) deux insaturations: 2 H2 fixés par réduction catalytique. la photoxydation d'une double liaison peut conduire deux dérivés carbonylés : ici la photooxydation donne une cétone ayant un carbone de moins que A, la double liaison est terminale >CH=CH2. La nouvelle cétone est également une méthylcétone ( test à l'iodoforme) : on doit avoir une structure -C(CH3)=CH2. Par isomérisation en milieu acide les doubles liaisons disubstituées peuvent donner des trisubstituées plus stables . l'oxydation par CrO3 donne :
UV : l'absorption à 230 nm indique une structure conjuguée IR : 17 18 cm-1 : vibration élongation >C=O ; 1608 cm-1 : élongation C=C 1380 cm-1 : liaison C-H déformation dans le plan 970 cm-1 : liaison C-H éthylénique déformation hors du plan RMN :0,9 ppm : H12 et H13 doublet ( 6 protons) 1,8 ppm : H10 singulet, déblindage par >C=C ( 3 protons) 2 ppm : H1 singulet, déblindage par >C=O ( 3protons) 4,85 ppm : H9 singulet, protons vinyliques ( 2 protons) 5,43 ppm : H6 doublet de doublet couplé avec H5 et H7. 5,93 ppm : H7 doublet spectre de masse : 43 : groupe CH3CO et isopropyle CH(CH3)2 151(194-43) : la srtucture complète moins l'un des groupes ci-dessus. retour - menu |