cristallochimie
![]() structure
cubique centrée de
l'uranium
mines
2000
structure
cubique centrée de
l'uranium
mines
2000
![]() structure
de l'oxyde de titanate de
baryum
mines
2001
structure
de l'oxyde de titanate de
baryum
mines
2001
L'uranium présente trois variètés allotropiques entre la température ambiante et sa température de fusion 1130°C. La phase a apparaît pout T<668°C. La phase b existe entre 668 et 775°C. La phase g est de structure cubique centrée pour 775 °C< T< 1132 °C. On demande de préciser quelques caractéristiques de la phase g.
- Dessiner une maille conventionnelle du réseau
cristallin associé à cette phase. Quelle
est la relation qui lie le côté a de la
maille et le rayon atomique de l'uranium ?
- Calculer le rayon atomique de l'uranium dans cette structure. - Calculer le nombre d'atomes par maille, la coordinence et la compacité.
- Calculer la masse volumique de l'uranium.
Données : M= 238 g/mol ; a= 350 pm ; NA= 6,023 1023 mol-1.
corrigé
maille cubique centrée
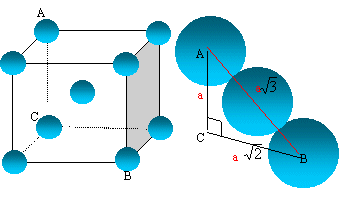
La tangence s'effectue suivant la grande diagonale du cube :
a racine carrée (3) = 4 R
Les 8 atomes situés aux sommets du cube sont communs à 8 mailles et comptent pour 1/8=0,125.
celui du centre, commun à une seule maille, compte pour une unité.
nombre d'atomes d'uranium appartenant à la maille : 8* 0,125 +1 = 2.
La coordinence est le nombre de plus proches voisins d'une sphère quelconque, ces voisins étant tangents à la sphère envisagée. Chaque atome d'uranium est au centre d'un cube, entouré de 8 autres atomes : coordinence = 8.
La compacité C, comprise entre 0 et 1, mesure le taux d'occupation de l'espace par les atomes ou les ions assimilés à des sphères. C= volume occupé / volume de la maille.
volume occupé : 2*(4/3pR3) ; volume de la maille : a3 ; et R/a = racine carrée (3) /4= 0,433
C= 8/3p (R/a)3=8/3*3,14*0,4333 = 0,68 , structure peu compacte.
la masse volumique m (kg m-3) est la masse d'une maille (kg) divisée par le volume de la maille (m3)
masse d'une maille : masse de deux atomes d'uranium = 2*masse molaire (kg) /nombre d'avogadro
soit 2*238 10-3 / 6,023 1023 = 7,9 10-25 kg
volume d'une maille a3 = (350 10-12)3= 4,29 10-29 m3.
m = 7,9 10-25 / 4,29 10-29 =1,8 104 kg m-3.
Les règles de construction des cristaux sont souvent énoncées comme suit dans le cas majoritaire où les anions sont les ions les plus gros.
règle 1 : Le cristal est électriquement neutre.
règle 2 : a- Les anions de rayons R forment un réseau ( dit réseau hôte), dans lequel les cations de rayon r, occupent les sites interstitiels.
b- Les cations sont entourés d'anions, la distance
cation-anion la plus courte est déterminée par
la somme des rayons ioniques ( les ions de signes
opposés sont considérés comme des
sphères dures en contact).
c- Le cation est entouré du plus grand nombre
d'anions pouvant géométriquement se trouver
à son contact ( coordinence maximale).
règle 3 : Dans une structure donnée le rapport de la charge sur la coordinence est la même en valeur absolue pour le cation et pour l'anion.
l'oxyde de baryum BaO possède la structure du
chlorure de sodium ; les ions oxydes constituent une
structure cubique à faces centrées, dont les
ions baryum occupent tous les sites octaèdriques.
Nous allons montrer que l'oxyde de baryum ne respecte pas
l'une des règles ci-dessus.
données : r= 134,4 pm ( ion baryum) et R= 140 pm (ion
oxyde) ; M=O=16 ; Ba= 137 g/mol ;
Z(oxygène)=8 ; Z(baryum)=56
;NA= 6,023 1023 mol-1.
- Quelles sont les charges respectives des ions les plus stables du baryum et de l'oxygène ? Justifier. Le composé BaO respecte-t-il la règle 1 ?
- Par quelle méthode expérimentale détermine-t-on la structure des cristaux ? Nommer la technique.
- Représenter la maille élémentaire de la structure du composé BaO. Donner la relation littérale entre la valeur de l'arète a et celles des rayons ioniques des ions. On détermine expérimentalement a=553 pm plus ou moins 5 pm. La règle 2a est-elle respectée ? calculer la masse volumique de BaO.
- Montrer que la plus grande sphère que l'on
peut insérer dans un interstice octadrique a un
rayon r0 tel que r0/R=0,414 (
racine carrée (2)-1) . On admettra que le rayon de
la plus grande sphère que l'on peut insérer
dans un autre site est :
- Interstice tétraèdrique : rT tel que rT/R= 0,23 ( racine carrée (1,5)-1 )
- Interstice cubique : rC tel que rC/R= 0,73 ( racine carrée (3)-1 )
- Rapeller la coordinence du cation dans chacun des trois types d'interstices. Compte tenu des valeurs des rayons r et R quel est le type d'interstice qui satisfait à la règle 2b dans le cas de l'oxyde de baryum ? La règle 2b est-elle respectée ? - A l'aide de la représentation de la maille élémentaire, dire si la règle 3 est respectée.
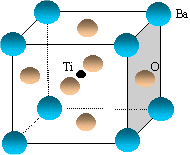
- Le titanate de baryum a pour formule
BaxTiyOz. A
l'aide du schéma de la maille
élémentaire représentée
ci-dessous, identifier la formule chimique du titanate de
baryum.
corrigé
L'élément baryum (Z=56) appartient à la famille des alcalino-terreux ; il donne facilement l'ion Ba2+ ; ce dernier à la structure électronique externe du gaz rare le plus proche, le xénon Xe.
L'élément oxygène posséde 6 électrons externes ; il donne facilement l'ion oxyde O2- ; ce dernier a la structure électronique externe du gaz noble le plus proche, le néon Ne.
L'oxyde de baryum respecte la règle n°1.
Les structures des cristaux sont obtenues par diffraction aux rayons X des monocristaux.
La structure est identique à celle du chlorure de sodium : cubique à faces centrées.
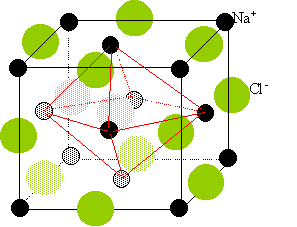
Les ions O2- constituent une structure cubique à faces centrées dont les ions Ba2+ occupent tous les sites octaédriques et réciproquement..
Le contact se fait le long d'une arète : a = 2(R+r)
application numérique : 2(140+134,4)= 548,8 pm
cette valeur est comprise entre 553-5 et 553+5 : la règle 2a est respectée.
Les anions O2- occupent les sommets du cube ( dont communs à 8 mailles, comptant pour 1/8) et aux centre des faces ( donc communs à 2 mailles comptant pour ½).
Les ions baryum sont situé au centre du cube ( commun à une maille) et au milieu des cotés ( donc communs à 4 mailles comptant pour un quart).
Une maille contient en propre 1+6*0,25 = 4 ions Ba2+ et 8*0,125 + 12*0,25 = 4 ions O2-.
masse d'une maille : 4(Moxygène + Mbaryum) 10-3 / NA= 4(16+137)10-3/6,023 1023=1,016 10-24 kg.
volume d'une maille : a3 =(556 10-12)3= 1,72 10-28 m3.
masse volumique : 1,016 10-24 /1,72 10-28 = 5,9 103 kgm-3.

Le long d'une arète a du cube il ya a deux atomes et une cavité octaèdrique : a=2R+2r0
et la tangence se fait le long de la diagonale d'une face : 2R= a rac.carrée(2) = 1,414 a
d'où r0 = ½a -R = (1,414 -1)a
Dans un interstice octaèdrique, la coordinence est 6 : les six atomes situés aux sommets de l'octaèdre entourent le site.
dans un interstice tétraèdrique, la coordinence est 4 : les quatre atomes situés aux sommets du tétraèdre entourent le site.
dans un site cubique la coordinence est 8 : les huit atomes situés aux sommets du cube entourent le site.
Dans le cas de l'oxyde de baryum r/R=0,96 > 0,73 donc à priori les trois structures sont possibles : la coordinence maximale et la règle 2c ne sont pas respectées.
Les deux réseaux cubiques faces centrées sont identiques pour Ba et O. Ils sont décalés de ½ a dans les trois directions : donc la coordinence est 6. Le titane est totalement inclus dans la maille et il compte pour 1.
Les ions baryum situés aux sommets du cube compte pour 8* 0,125 = 1 .
Les ions O2- situés aux centres des faces comptent pour : 6* ½=3
d'où la formule du titanate de baryum : BaTiO3.
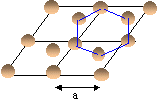
Le graphite est formé de couches hexagonales coplanaires distante de d= 335 pm. Le rayon du carbone est R=71 pm. dans l'empilement des atomes d'un hexagone du plan B sont décalés au-dessus des centres des hexagones du plan A.
- Représenter la structure à partir des caractéristiques ci-dessus.
- On donne ci-dessous la maille
élémentaire vue de dessus. En
déduire le paramètre a de la maille en
fonction du rayon du carbone R.
- Calculer la masse volumique du graphite et sa compacité.
- Pourquoi le rayon de l'atome dans le diamant est-il
plus grand que dans le graphite ?
C= 12 g/mol ; NA= 6,023 1023 mol-1.
corrigé
Dans le plan la tangence se fait le long d'un côté a de l'hexagone.
L'atome "bleu" est au centre d'un triangle équilatéral de côté a. dans ce triangle la hauteur h= 0,866 a
or les hauteurs se coupent aux 2/3 donc 2R=2/3 h = 0,666 *0,866 a = 0,577 a.
d'où a = 2R/0,577 = 2*71/0,577 = 246 pm.
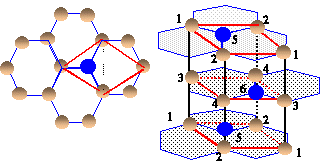
La maille étudiée est représentée en traits gras.
les quatre atomes notés "1" appartiennent chacun à 12 mailles et contribuent pour 1/12 * 4= 1/3
les quatre atomes notés "2" appartiennent chacun à 6 mailles et contribuent pour 1/6 * 4= 2/3
les deux atomes notés "3" appartiennent chacun à 6 mailles et contribuent pour 1/6 * 2= 1/3
les deux atomes notés "4" appartiennent chacun à 3 mailles et contribuent pour 1/3 * 2= 2/3
les deux atomes notés "5" appartiennent chacun à 2 mailles et contribuent pour 1/2 * 2= 1
l' atomes noté "6" appartient en propre à la maille.
total : 4 atomes par maille.
masse volumique : m
masse de ces 4 atomes : 4*Mcarbone / NA= 4*12 10-3/ 6,023 1023 = 7,97 10-26 kg.
volume de la maille : surface de base / hauteur = a2 sin60*2d
(246 10-12)2*0,866*2* 335 10-12 = 3,51 10-29 m3.
m= 7,97 10-26 / 3,51 10-29 = 2,27 103 kg m-3.
compacité C : volume des 4 atomes / volume de la maille
volumes des 4 atomes = 4*4/3pr3= 16/3*3,14*(71 10-12)3= 6 10-30 m3.
C= 6 10-30 / 3,51 10-29 =0,17.
Dans le diamant la liaison C-C est simple alors que dans le graphite elle est intermédiaire entre une liaison simple et une liaison double.
retour - menu