![]() oxydo-réduction
d'après
Mines 01
oxydo-réduction
d'après
Mines 01
- Donner la structure électronique de l'atome de carbone 126C ; on précisera la règle de Hund. Dans quel genre d'interaction se manifeste le spin électronique ?
- La chimie organique a pour objet l'étude des
composés du carbone. En raison des analogies entre
les atome 6C et de silicium 14Si,
on a très tôt songé à batir
une chimie organique du silicium. Justifier ces
analogies.
- Quelle est la principale utilisation actuelle du silicium ? - Quelle règle simple permet, en
général, de prévoir le nombre de
liaisons covalentes auxquelles participent les
éléments des 2ème et
3ème périodes de la
classification périodique.
- Quelle est la géomètrie habituelle du carbone tétravalent. Donner un exemple.
- Déterminer la structure de Lewis et la géomètrie des molécules CO et CO2.
- Donner une définition qualitative du concept d'électronégativité ; quel rapport peut-on faire avec certains comportement observés en chimie ?
- Comparer les polarisations des molécules CO et CO2.
corrigé
structure électronique de l'atome de carbone : 1s² 2s² 2p².
règle de Hund : lorsqu'un niveau d'énergie est dégénéré et que le nombre d'électrons est insuffisant pour compléterce niveau, l'état de plus basse énergie s'obtient en utilisant le plus grand nombre d'orbitales dans lesquelles les spins des électrons non appariès sont parallèles. Pour le carbone, 2 électrons occupent deux orbitales 2p.
Le spin électronique intervient dans les interactions avec un champ magnétique extérieur.
Les atomes de carbone et de silicium appartenant à la même colonne de la classification périodique possèdent le même nombre d'électrons externes : ils ont donc des propriètès chimiques voisines; en particulier ils établissement 4 liaisons de covalence.
Les silicones sont les composés du silicium et de l'hydrogène correspondants aux hydrocarbures de la chimie organique.
le silicium est le matériau de base de l'électronique : ce semi-conducteur est utilisé dans les circuits intégrés et dans les photopiles.
règle de l'octet : lors de la formation de molécules, les atomes tendent à acquérir la structure électronique externe du gaz noble le plus proche. Cette règle permet de prévoir le nombre de liaisons de covalence auxquelles participent les éléments des 2ème et 3ème périodes.
pour le carbone : 8-4 = 4 liaisons; pour l'azote 8-5 = 3 liaisons
le carbone tétravalent est tétraèdrique : c'est le cas de CH4. L'atome de carbone est au centre d'un tétraèdre, les 4 atomes d'hydrogène sont situés sur les sommets du tètraèdre.
![]()
ces deux molécules sont linéaires.
L'électronégativité caractérise l'aptitude d'un atome à attirer à lui les électrons d'une liaison : l'électronégativité permet de prèvoir la polarité des molécules
La molécules de CO2 ,du fait de sa symétrie n'est pas une molécule polaire ; la molécule CO étant constituée de deux atomes d'électronégativité différente, ne présentant pas de symétrie, possède un moment dipolaire.
Les premiers alcanes méthane CH4, propane C3H8, butane C4H10 sont utilisés comme combustibles. A température ambiante, la combustion d'un alcane gazeux CnH2n+2, dans une quantité suffisante de dioxygène donne du dioxyde de carbone et de l'eau. A 25°C sous 1 bar :
enthalpie standart de formation DfH0 en kJ/mol : CO2 gaz : -330 ; H2O liquide : -286 ; C gaz :719.
enthalpie standart de liaison DliaisH0 en kJ/mol :H-H : 435 ; C-C 360 ; C-H : 418.
- Quelle est la signification du signe d'une enthalpie de réaction ? Que signifie "standart" ? Que signifie " enthalpie standart de formation " ?
- On appelle réaction d'atomisation, la réaction au cours de laquelle une molécule gazeuse est entièrement décomposée en ses atomes à l'état gazeux. Pour un alcanes écrire l'équation bilan de la réaction d'atomisation et exprimer littéralement l'enthalpie standart de la réaction DatH0 en fonction de n et des données.
- Ecrire l'équation bilan de la combustion d'une mole d'alcane. A l'aide d'un cycle enthalpique, exprimer numériquement son enthalpie standart DrH0298 en fonction de n et des données.L'état standart du carbone à 298 K est le graphite.
- Lorsque l'on effectue la combustion de n moles d'alcane dans les conditions précédentes, comment s'exprime par rapport à DrH0298 l'énergie libérée. Exprimer alors l'énergie q(n) libérée par la combustion de 1 kg d'alcanes en fonction de n et des données.
- Comparer q(n) pour les trois alcanes cités plus haut.
- La capacité thermique de l'eau liquie étant prise égale à 4,2 kJ K-1 kg-1 entre 20 et 100 °C, calculer pour chacun des 3 combustibles la quantité minimale ( en moles) de dioxyde de carbone produit lorsqu'on chauffe 1 L d'eau de 20 °C à 100 °C.
- Conclure quant aux qualités comparées des combustibles étudiés.
corrigé
Le signe de enthalpieindiquer si une réaction est endothermique ( signe positif) ou exothermique ( signe négatif).
Le terme "standart" d'un constituant correspond à la pression standart ( 105 Pa); la température n'est pas fixée.
L'enthalpie standart de réaction à la température T est l'enthalpie de réaction liée à une transformation chimique où tous les constituants sont dans leur état standart.
équation bilan de la réaction d'atomisation d'un alcane :
CnH2n+2 (g) --> n C(g) + 2n+2 H (g)
DatH0 = (n-1) DliaisH0 (C-C) + (2n+2)DliaisH0 (C-H)
DatH0 = (n-1)*360+(2n+2)*418 = 1196 n + 476 kJ mol-1.
équation bilan de la réaction de combustion d'un alcane :
CnH2n+2 (g) + (1,5 n +½ ) O2(g) --> n CO2(g) + (n+1) H2O (liq)
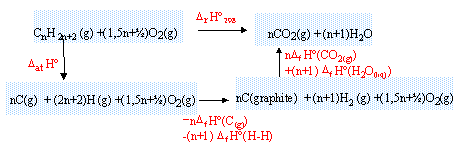
l'enthalpie standart DrH0298 s'exprime :
DrH0298 = DatH0 - n DfH0 (C(g))-(n+1)DliaisH0 (H-H)+ n DfH0 (CO2(g))+ (n+1)DfH0 (H2O(liq))
DrH0298 =1196n+476-719n-(n+1)*435-330 n +(n+1)*(-286)
DrH0298 =-574 n -245 kJ mol-1.
combustion de n moles d'alcanes : Q= n |DrH0298 |
énergie libérée par la combustion de 1 kg d'alcanes : q(n) = 103 |DrH0298 | / masse molaire = 103 |DrH0298 | / (14n+2)
q(n) = 103(574n+245/ / (14n+2)
méthane (n=1) : 51,2 MJ kg-1 ; propane (n=3) : 44,7 MJ kg-1 ; butane (n=4) : 43,8 MJ kg-1 ;
Energie nécessaire pour chauffer 1 L d'eau de 20 à 100 °C :
Q= mcDt= 1*4,2*(100-20) = 336 kJ
masse d'alcane nécessaire : 336/51,2 103 = 6,56 g de méthane
336/44,7 103 = 7,51 g de propane ; 336/43,8 103 = 7,67 g de méthane
Qté de matière de CO2 libérée : 6,56 / 16 = 0,41 mol à partir de CH4 ;
3*7,51 / (14*3+2) = 0,51 mol à partir de C3H8 ;
4*7,67 / (14*4+2) = 0,53 mol à partir de C3H8 ;
Le méthane est le meilleur combustible: il libère moins de CO2 que les deux autres alcanes. (augmente moins l'effet de serre)
couples acide base : CO2(dissout) / HCO3- pKa1= 6 ; HCO3- / CO32- pKa2= 10 ; pH moyen de l'eau de mer : 8,5
- On s'interesse tout d'abord aux différentes formes du dioxyde de carbone dissout dans l'eau : CO2(dissout) ; HCO3- ;CO32- (ion carbonate) . Représenter le diagramme de prédominance de ces trois espèces.
- On relève sur l'étiquette d'une eau minérale les informations suivantes : magnésium : 110 mg/L ; sodium : 14 mg/L ; sulfates 1479 mg/L ; hydrogénocarbonates 403 mg/L; pH=7. On peut s'étonner que l'etiquette ne mentionne pas la quantité d'ion CO32- ; pour répondre à cette question calculer la concentration d'ions CO32- dans cette eau, puis la masse correspondante en mg/L. Conclure.
- Dans une eau de pH neutre ou légerement
basique, on peut envisager la réaction de bilan
:
2HCO3- = CO32- +CO2 + H2O. Commenter le comportement de l'ion hydrogènocarbonate dans cette réaction. Comment appelle-t-on les corps qui se comportent ainsi ?
Il y a lieu de penser que l'atmosphère primitive de notre planète était riche en dioxyde ce carbone ; d'autre part on observe de grande quantité de cyanobactéries fossiles. Sachant que les cyanobactéries marines pratiquent la photosynthèse à partir du dioxyde de carbone dissout, expliquer sans calculs pourquoi :
- Les cyanobactéries fossiles sont associées à d'importants dépôts calcaires.
- Le dioxyde de carbone n'est plus qu'un constituant minoritaire de l'atmosphère terrestre.
corrigé
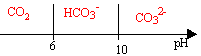
à pH=7 l'ion hydrogénocarbonate HCO3- prédomine. Les ions carbonates CO32- sont minoritaires.
à l'équilibre : Ka2 = [H3O+][CO32-] / [HCO3-]
[CO32-] = Ka2 [HCO3-] / [H3O+] avec [HCO3-] =0,403 / (1+12+48)= 6,61 10-3 mol/L
[CO32-] = 10-10 * 6,61 10-3 / 10-7 = 6,61 10-6 mol/L
masse correspondante : 6,61 10-6 *(12+48)= 0,4 mg/L.
les ions carbonates sont en quantité très faible, difficilement détectable.
Dans une eau à pH neutre, les ion hydrogénocarbonate joue un double rôle, d'acide et le rôle de base : ils sont amphotères
Les cyanobactéries marines mettent en oeuvre la photosynthèse à partir du dioxyde de carbone dissout : ce dernier étant consommé, l'équilibre de dissolution CO2(g) = CO2(dissout) est déplacé dans le sens direct ( consommation du CO2 atmosphérique)
L'utilisation du CO2 dissout par les cyanobactéries déplace l'équilibre 2HCO3- = CO32- +CO2(dissout) + H2O dans le sens direct, formation des ions carbonates CO32- ; la concentration de ces derniers augmente et entraîne la précipitation du calcaire.
L'extraction
du pétrole s'accompagne de la libération de
méthane ; l'exploitation terrestre permet la
récupération de ce gaz et son acheminement par
gazoduc, ce qui n'est pas possible à partir d'une
plate forme off-shore. Le méthane ainsi
libéré s'échappe dans
l'atmosphère, contribuant à l'effet de serre..
Les pétroliers envisagent de le recueillir pour le
transformer en méthanol, liquide plus facile à
transporter. Le méthanol CH3OH peut
être utiliser en synthèse organique ; il peut
aussi servir de combustible thermique, ou encore alimenter
une pile d'oxydoréduction.
Données : H=1 ; C=12 ; O=16 g/mol ; e = 1,6 10-19 C ; N= 6,02 1023 mol-1 ;
CO32-/ CH3OH : potentiel standart à pH=0 : E10= 0,18 V ;
H2O2/ H2O : potentiel standart à pH=0 : E20= 1,78 V ;
O2 / H2O2 : potentiel standart à pH=0 : E30= 0,68 V ;
- Le
fonctionnement de la pile envisagée suppose
l'oxydation du méthaol en carbonate. Ecrire la
demi-équation redox correspondante et calculer la
masse de méthanol oxydée par heure pour un
courant de 1 A.
- Compte tenu des objectifs écologiques annoncés, pourquoi faudra-il effectuer la réaction en milieu basique ? - On réalise une pile utilisant des électrodes de platine, les "combustibles " étant le méthanol et le peroxyde d'hydrogène H2O2. Faire un schéma du principe de la pile. On placera en justifiant anode, cathode, pôles moins et plus.
- Ecrire les demi-équations redox mises en jeu dans cette pile, ainsi que les potentiels de Nernst correspondants.
- ecrire
l'équationbilan de fonctionnement de la pile en
milieu basique ; se fera-t-elle d'autant mieux que le
milieu sera plus ou moins basique ?
- Calculer la valeur de sa constante d'équilibre.
corrigé
demi-équation correspondant à l'oxydation du méthanol en carbonate :
CH3OH + 2H2O = CO32-+ 8H+ + 6e-
Quantité d'électricité Q= I t = 1*3600 = 3600 C
La charge d'une mole d'électron est égale à 1F =96500 C
n( électrons) = 3600/96500=0,0374 mol
masse de méthanol oxydé : 0,0374/6 = 6,22 10-3 mol soit en masse 6,22 10-3 *(12+4+16)=0,20 g.
En travaillant en milieu basique on obtient des ions carbonates ; en milieu acide on obtiendrait du CO2 contribuant à l'effet de serre.
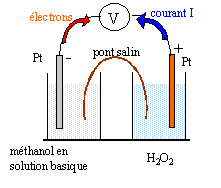
méthanol réducteur oxydé à l'anode négative : CH3OH + 2H2O = CO32-+ 8H+ + 6e- (1)
potentiel de Nernst : E1 =E01 + 0,06 /6 log ( [CO32-][H+]8/[CH3OH])
H2O2 oxydant le plus fort réduit à la cathode positive : 3 fois {H2O2 +2H+ + 2e- = 2H2O }(2)
potentiel de Nernst : E2 =E02 + 0,06 /2 log ( [H+]2[H2O2 ])
réaction bilan de fonctionnement de la pile :
CH3OH +3H2O2 -->CO32-+ 2H+ +4 H2O en milieu acide
CH3OH +3H2O2 + 2HO- --> CO32- +6 H2O en milieu basique
se fait d'autant mieux que le milieu est plus basique.
K = [CO32-] / ([CH3OH][H2O2 ]3[HO-]2) = [CO32-][H+]2 / ([CH3OH][H2O2 ]3[HO-]2[H+]2)
K = [CO32-][H+]2 / ([CH3OH][H2O2 ]3 Ke2)
à l'équilibre thermodynamique E1 =E2
E01 +0,01 log ( [CO32-][H+]8/[CH3OH]) = E02 +0,03log ( [H+]2[H2O2 ])
(E02 - E01)=0,01 log([CO32-][H+]2/ ([CH3OH][H2O2 ]3) =0,01 log (K Ke2)
(E02 - E01) / 0,01 =100 (E02 - E01) =log (K Ke2)
10100 (E2 - E1) = K Ke2 soit K= Ke-2 10100 (E2 - E1) = 1028 * 10160 = 10188.
retour - menu