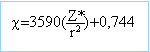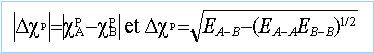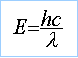|
|
|||||||||||||||||||
|
|||||||||||||||||||
|
échelle d'Allred-Rochow |
rayons covalents en pm : F (71) ;Cl (99) ; Br (114) ; I (133) numéro atomique : F (9) ; Cl (17) ; Br (35) ; I (53) corrigé |
||||||||||||||||||
|
aptitude que possède un atome à s'approprier le doublet de liaison l'associant à un autre atome. configuration électronique : F : 1s2 2s2 2p5. Cl : 1s2 2s2 2p6 3s2 3p5. Br : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5. I : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5. charge effective Z* : F : Z* = 9-(6*0,35+2) = 4,9 Cl : Z* = 17-(6*0,35+8*0,85+2) = 6,1 Br : Z* = 35-(6*0,35+18*0,85+10) = 7,6 I : Z* = 53-(6*0,35+18*0,85+28) = 7,6 électronégativité : F : c =4,23 ; Cl : c =2,98 ; Br : c =2,84 ; I : c =2,28 . L'électronégativité diminue quand le numéro atomique augmente, au sein d'une même famille.
|
|||||||||||||||||||
|
électronégativité de Mulliken |
F : E=17,4 et A=3,4 ; Cl : E=13 et A=3,62 ; Br : E=11,8 et A=3,37 ; I : E=10,5 et A=3,06 . corrigé |
||||||||||||||||||
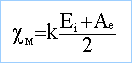
L'application numérique donne : cM(F )=3,3 ; cM(Cl )=2,6 ; cM(Br )=2,4 ; cM(I )=2,15 . L'électronégativité diminue quand le numéro atomique augmente, au sein d'une même famille. L'électronégativité augmente avec le numéro atomique, dans une période.
|
|||||||||||||||||||
|
échelle de Pauling |
lH-Cl=127 pm ; 1D=3,3 10-30 Cm ; e=1,6 10-19 C ; h=6,62 10-34 Js ; c=3 108 ms-1. |
||||||||||||||||||
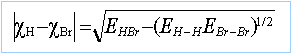
application numérique : cBr =2,96 et cCl =3,15 EBr-Cl =213,1 kJ mol-1. chlorure de brome
longueur d'onde en mètre et E en joule. application numérique : l =548 nm visible
énergie d'attachement électronique négative : X(g)+ e- -->X-(g)
p = 0,18*1,6 10-19*127 10-12 = 3,66 10-30 C m 3,66 10-30 / 3,3 10-30 = 1,1 D. |