|
|
|
|
P pression en pascal V volume en m3 n moles R=8,31 Jmol-1K-1 T en kelvin DU =Cv DT la variation d'énergie interne (joule) d'un gaz parfait ne dépend que de la variation de température. Cv capacité thermique à volume constant J K-1 T en kelvin Cp-Cv=nR Cp capacité thermique à pression constante J K-1 transformation adiabatique PVg =constante g=1,4 l'énergie échangée avec l'extérieur est nulle le travail échangé avec l'extérieur est égal à DU transformation isobare La pression reste constante l'énergie échangée avec l'extérieur est Cp DT le travail échangé avec l'extérieur est égal à -P DV transformation isochore le volume reste constant l'énergie échangée avec l'extérieur est DU le travail échangé avec l'extérieur est nul transformation isotherme la température reste constante l'énergie interne ne varie pas
|
|
|
|
|
||||||||||||||||||||
|
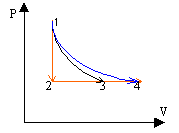
Un gaz parfait peut subir différentes transformations réversibles pour passer de l'état initial (1) au même état final (4):
corrigé courbe (1) à (2) : isochore et courbe (2) à (4) isobare : transformation b courbe (1) à (3) adiabatique et courbe (3) à (4) isobare : transformation c courbe (1) à (4) isotherme : transformation a.
n = P1 V1 /(RT1) = 1,6 105*0,08 /(8,31*300) n= 5,13 mol
volume (1) = volume (2) isochore T (4) =T (1) isotherme T2 = P2 V2 / (R n) =0,8 105*0,08/(8,31*5,13) T2 = 150 K
1,6 105*0,081,4 = 0,8 105 V31,4 V3 = 131 L
transformation (1) -->(2) : pas de travail, car volume constant transformation (2) -->(4) : isobare travail échangé : -
P2( V4-V2) = -0,8
105*0,08 = -6,4 kJ.
transformation (1) -->(2) : Q= n Cv (T2-T1) 5,13*20,8*(-150) = -16 kJ. transformation (2) -->(4) : Q= n CP (T4-T2) 5,13*29,12*150 = 22,4 kJ.
|
|||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
Données Constante des gaz parfaits : R= 8,31 J.mol-1. K-1. Masse molaire atomique : 0 =16g.mol-1. corrigé PV= nRT gaz parfait P pression en pascal ; V volume en m3 ; n moles ; R=8,31 Jmol-1K-1 ; T en kelvin
volume : 10 L=0,01 m3; presion P= 200 bars = 200 105 Pa ; T= 273+20= 293 K n = PV / (RT) = 200 105 *0,01 / (8,31*293) = 82,14 mol masse molaire O2 : 16*2 =32 g/mol masse de gaz : 82,14*32 = 2628,5 g. La température augmente, le volume de la bouteille reste inchangé: la pression du gaz va augmenter (compression) La quantité de matière (mol) de gaz ne change pas ( pas d'ouverture de la bouteille) nouvelle pression P2 : P2 = nRT2 / V = 82,14*8,31*(273+30) / 0,01 = 206,82 105 Pa = 206,82 bars la température ne change pas, le volume de la bouteille ne change pas, la pression diminue (détente du gaz), la quantité de matière du gaz diminue T2=273+30=303K; V=0,01 L; P=200 105 Pa n2 = 200 105*0,01 /(8,31*303) = 79,43 mol soit 82,14-79,43 =2,71 mol de gaz extrait. volume du gaz extrait : T2=273+30=303K; P= 105 Pa ; n= 2,71 mol V= nRT2 / P = 2,71 *8,31*303 / 105 =6,82 10-2 m3 = 68,2 L.
|
|||||||||||||||||||||