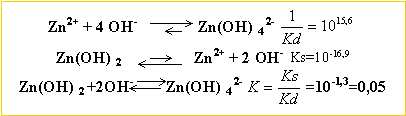|
|
|
|||||
|
degré II : organisation horizontale |
pas=16,2 ; pKd=15,6 . Quels sont les pH séparant :
on prendra C0= 0,01 mol L-1 , concentration maximale d'une espèce en solution. corrigé |
|||||
|
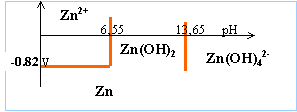
[OH-]² =1,25 10-17 / 0,01 =1,25 10-15 d'où [OH-]= 3,53 10-8 mol L-1. produit ionique de l'eau : [H3O+][OH-]= 10-14 à 25 °C [H3O+] = 2,82 10-7 --> pH = 6,55 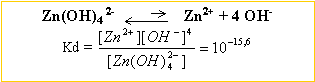
à partir des 2 constantes des 2 réactions ci dessus, cherchons la constante d'équilibre K de la réaction : Zn(OH)2 + 2 OH- en équilibre avec Zn (OH)42-.
K= [Zn (OH)42-] / [OH-]2 = 0,05 C0 /[OH-]2 = 0,05 d'où [OH-] =0,447 mol L-1. produit ionique de l'eau : [H3O+][OH-]= 10-14 à 25 °C [H3O+] = 2,23 10-14 --> pH = 13,65 je conclus :
les solides n'existent pas en dehors de leur domaine. En revanche pour les espèces en solution, il s'agit de domaine de prédominance, dans lesquels d'autres espèces sont minoritaires. |
||||||
|
loi de Nernst |
Pour chaque intervalle de pH trouvé ci dessus écrire la loi de Nernst :
corrigé |
|||||
|
E= -0,76 + 0,03 log [Zn2+] avec C0= 0,01 mol/L E= -0,76 -0,06 = -0,82 V
Zn(OH)2 + 2H3O+ + 2e---> Zn + 4 H2O E=Eo Zn(OH)2/Zn + 0,03 log [H3O+]² E = Eo Zn(OH)2/Zn - 0,06 pH Le coefficient directeur de cette droite est proportionnel à la puissance de [H3O+] et inversement proportionnel au nombre d'électrons échangés. il n'est pas nécessaire de connaître Eo Zn(OH)2/Zn le principe de continuité du graphe permet de tracé cette droite.
Zn(OH)42- + 4H3O+ + 2e---> Zn + 8 H2O E=Eo Zn(OH)4(2-)/Zn + 0,03 log [Zn(OH)42-][H3O+]4 E = Eo Zn(OH)4(2-)/Zn - 0,12 pH + 0,03 log [Zn(OH)42-] E = Eo Zn(OH)4(2-)/Zn - 0,12 pH + 0,03 log 0,02 Le coefficient directeur de cette droite est proportionnel à la puissance de [H3O+] et inversement proportionnel au nombre d'électrons échangés. il n'est pas nécessaire de connaître Eo Zn(OH)4(2-)/Zn le principe de continuité du graphe permet de tracé cette droite.
|
||||||
|
|
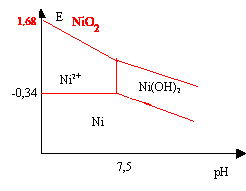
On limite le diagramme aux espèces suivantes: solides: Ni ; Ni(OH)2 ; NiO2 ; ions: Ni2+. La concentration de tracé est égale à 0,001 mol.L-1.
Données: Potentiels standards d'oxydo-réduction: Ni2+ / Ni: - 0,25 V ; NiO2 / Ni2+ 1,59 V Produit de solubilité de Ni(OH)2 : Ks = 10-16. corrigé pour le nickel métal : n.o(Ni)=0 et 2 pour les autres composés Ni2+ et Ni(OH)2 Ni(OH)2 (s) = Ni2+ et 2 HO- produit de solubilité : 10-16 = [Ni2+][OH-]2 avec [Ni2+]=0,001 mol/L 10-13= [HO-]² soit [HO-]=3,16 10-7 [H+]=10-14/[HO-] à 25°C soit [H+]=3.16 10-8 ; pH= 7,5. si pH <7,5frontière entre Ni et Ni2+ ; Ni = Ni2+ + 2e- E= -0,25 + 0,06/2 log [Ni2+]=-0,25 +0,03 log 0,001=-0,34 V si pH supérieur à 7,5 frontière entre Ni et Ni(OH)2 [Ni2+]= 10-16 /[HO-]2 E= -0,25 + 0,03 log (10-16 /[HO-]2) E= -0,25 + 0,03 log (10-16 /10-28*[H+]²) E= -0,25 + 0,36 -0,06 pH=0,11 -0,06 pH.
frontière NiO2/Ni2+ : NiO2 (s)+ 4H+ + 2e- = Ni2+ + 2H2O E= 1,59 + 0,03 log([H+]4 / [Ni2+]) avec [Ni2+] = 0,001 mol/L E = 1,59+ 0,03 log 103 -0,03*4 pH=1,68 - 0,12 pH. frontière NiO2/Ni (OH)2 : Ni(OH)2 (s) = Ni2+ et 2 HO- produit de solubilité : 10-16 = [Ni2+][OH-]2 E= 1,59 + 0,03 log([H+]4 / [Ni2+]) avec [Ni2+] =10-16 /[OH-]2 =10-16 /10-28*[H+]2=1012*[H+]2 E= 1,59 + 0,03 log([H+]2 / 1012 )=1,23 -0,06 pH. |
|||||
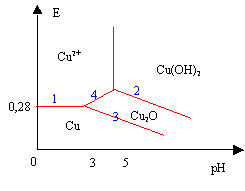
données : E1°(Cu+/Cu) = + 0,52 V ; E2°(Cu2+/Cu+) = + 0,16 V Cu(OH) n'existe pas en solution aqueuse : il se transforme spontanément en Cu2O (oxyde solide) selon la réaction suivante: 2 Cu+ + 2 OH- = Cu2O + H2O pKS1 = 30 Cu(OH)2 = Cu2+ + 2 HO- pKS2 = 20 La concentration de travail est de 0,01 mol.L-1 corrigé Cu(s) : n.o=0 ; Cu+ et Cu2O : n.o = 1 ; Cu2+ et Cu(OH)2 : n.o=2 apparition de Cu(OH)2 : 10-20=[Cu2+][OH-]² avec [Cu2+][=0,01 mol/L ; 10-20=0,01[OH-]² ; 10-18=10-28/[H+]² ; [H+]=10-5 ; pH=5. le diagramme potentiel pH Cu+ +e- = Cu ; E1=0,52 V Cu2+ + e- = Cu2+ ; E2=0,16 V donc : Cu2+ + 2e- =Cu(s) ; E0= (0,52+0,16)/2 = 0,34 V E (Cu
2+/Cu)=0,34 + 0,03 log [Cu2+]
= 0,34 + 0,03 log 10-2 =
0,28 V
droite (1)
2Cu2++ 2 e- =2Cu+ ; E (Cu2+/Cu+)= 0,16 + 0,06 log ([Cu2+]/[Cu+] ) or : [Cu2+][HO-]²= 10-20 ou [Cu2+]²[HO-]4= 10-40 [Cu+]²[HO-]²= 10-30. soit [Cu2+]/[Cu+]=10-5/[HO-] =109*[H+] E (Cu (OH)2/Cu2O)= 0,16 + 0,06*9-0,06pH = 0,7 -0,06 pH ( droite 2) E (Cu2O/Cu)= 0,52 + 0,06 log ([Cu+] ) avec [Cu+]=10-15/[HO-] =10-1*[H+] E (Cu2O/Cu)= 0,52 - 0,06-0,06pH = 0,46 -0,06 pH ( droite 3) intersection des droites 3 et 1 : 0,28 = 0,46-0,06 pH donne pH=3 Cu2O précipite à partir de pH = 3.
droite 4 : Cu2++ e- =Cu+ et 2 Cu+ + 2 OH- = Cu2O (s) + H2O E (Cu 2+/Cu2O)= 0,16 + 0,06 log ([Cu2+]/[Cu+]avec[Cu+]²[HO-]²= 10-30. E (Cu 2+/Cu2O)= 0,16 + 0,06 log (10-2/ 10-15*[HO-]) = 0,16 + 0,06 log (1013* 10-14/[H+]) E (Cu 2+/Cu2O)= 0,16 - 0,06 *1+0,06 pH E (Cu 2+/Cu2O)= 0,1 + 0,0,6 pH ( droite 4)
|
||||||
|
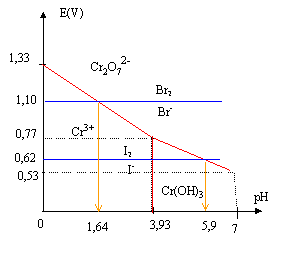
On se propose d’étudier le pouvoir oxydant du chrome (VI) en fonction du pH. On considérera uniquement les espèces Cr2O72-(aq), Cr3+(aq), Cr(OH)3(s).
On donne: Couple Potentiel standard à 25°C en V :Cr2O72-(aq)/ Cr3+(aq)= 1,33 ; I2(aq)/ I-(aq) : 0,62 ; Br2(aq)/ Br-(aq)= 1,10 Produit de solubilité à 25 °C : Cr(OH)3 : pKS = 30,2 corrigé produit de solubilité :10-30,2 = [Cr3+][HO-]3 avec [Cr3+]=1mol/L doù [HO-]= racine cubique (6,3 10-31)=8,57 10-11 mol/L produit ionique de l'eau :[H3O+]= 10-14/[HO-]=1,17 10-4 ; pH= log1,17 10-4 =3,93. frontière entre Cr2O72- et Cr3+ : Cr2O72-+ 14 H+ + 6e- = 2 Cr3+(aq)+7H2O. E = E0 + 0,01 log ([Cr2O72-] [H+]14/[Cr3+]2) avec [Cr2O72-] =[Cr3+] = 1 mol/L E=1,33 +0,01*14 log[H+] = 1,33 +0,14log [H+] = 1,33-0,14 pH. frontière entre Cr2O72- et Cr(OH)3 : E = E0 + 0,01 log ([Cr2O72-] [H+]14/[Cr3+]2) avec [Cr3+] =10-30,2 / [HO-]3 et [HO-] =10-14/ [H+] [Cr3+] = 10-30,2 [H+]3 / (10-14)3=1011,8 [H+]3 . E = E0 + 0,01 log ([Cr2O72-] [H+]14/[1011,8 [H+]3]2) E = E0 + 0,01 log ([Cr2O72-][H+]8/1023,6) vec [Cr2O72-] =[ 1 mol/L E=1,33 + 0,08 log[H+]-0,236 = 1,094 -0,08pH.
Il est possible d’oxyder les ions iodure sans oxyder les ions bromure en utilisant l’oxydant Cr(VI) : 1,10 = 1,33-0,14pH donne pH= 1,64 Les ions Br- peuvent être oxydés en Br2 si pH <1,64 par l'ion dichromate. 0,62 = 1,094-0,08pH donne pH= 5,92 Les ions I- peuvent être oxydés en I2 si pH <5,92 par l'ion dichromate. On peut oxyder I- sans oxyder Br- dans l'intervalle de pH : ]1,64 ; 5,9[ |
||||||
|
Diagramme E = f(pH) de l'eau de chlore : Le diagramme potentiel – pH joint permet de prévoir l'évolution en fonction du pH des propriétés oxydo-réductrices des espèces chlorées en solution aqueuse. Les concentrations molaires des espèces dissoutes y sont supposées égales à 0,1 mol.dm-3. 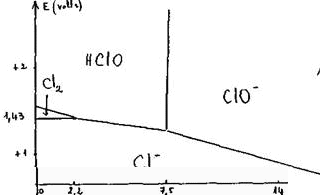
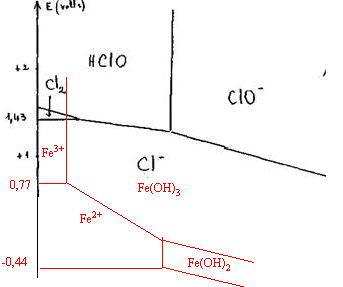
données: E° (Fe3+ / Fe2+) = 0,77 V produits de solubilité des hydroxydes: KsII Fe(OH)2 = 10 -15 ; KsIII Fe(OH)3 = 10 -37. corrigé pH à partir duquel Fe(OH)2 précipite : Fe(OH)2 (s)= Fe2+ + 2HO- ; 10 -15 =[Fe2+][HO-]² avec[Fe2+]=0,1 mol/L [HO-]²= 10-14 ; [HO-] = 10-7 soit pH=7. pH à partir duquel Fe(OH)3 précipite : Fe(OH)3 (s)= Fe3+ + 3HO- ; 10 -37 =[Fe3+][HO-]3 avec[Fe3+]=0,1 mol/L [HO-]3= 10-36 ; [HO-] = 10-12 soit pH=2.
L'eau de chlore oxyde les solutions ferreuses à tout pH. à pH=0 : 2Fe2+ = 2Fe3+ +2 e-. HClO +2e-+ H+ = Cl- +H2O HClO + 2Fe2+ + H+ = Cl- + H2O + 2Fe3+ à pH=4 : 2Fe2+ + 6H2O = 2Fe(OH)3 + 2 e-+ 6 H+. HClO +2e-+ H+ = Cl- +H2O HClO + 2Fe2+ +5H2O = Cl- + 5 H+ + 2Fe(OH)3 à pH=10 : 2Fe(OH)2 + 2H2O = 2Fe(OH)3 + 2 e-+ 2 H+. ClO- +2e-+ H2O = Cl- +2HO- ClO- + 2Fe(OH)2 +H2O = Cl- + 2Fe(OH)3
|
||||||
|