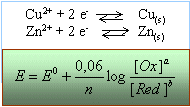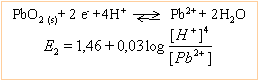|
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
pile Daniell |
Une pile Daniell est constituée d'une électrode de cuivre plongeant dans une solution de sulfate de cuivre et d'une électrode de zinc plongeant dans une solution de sulfate de zinc. E0 (Cu2+ / Cu) = 0,34 V ; E0 (Zn2+ / Zn) = 0,34 V ;
corrigé |
||||||||||||||||||||
|
pour le cuivre : ECu = 0,34 + 0,03 log [Cu2+] pour le zinc : EZn = -0,76 + 0,03 log [Zn2+] Même si les concentrations sont très différentes les unes des autres ECu > EZn Le cuivre est l'électrode positive: les ions Cu2+ se réduisent, c'est la cathode. Le zinc est l'électrode négative: le zinc s'oxyde c'est l'anode Zn + Cu2+ -->Zn2+ + Cu fem de la pile : ECu = 0,34 + 0,03 log 0,1 = 0,31 V EZn = -0,76 + 0,03 log 0,1 =-0,79 V E = ECu -EZn = 1,1 V
|
|||||||||||||||||||||
|
accumulateur au plomb |
L'accumulateur au plomb est la pile : Pb, PbSO4 /H2SO4(1 mol L-1) /PbSO4, PbO2.
E0(Pb2+/Pb)=-0,13 V ; E0(PbO2/Pb2+)=1,46 V ; pKs(PbSO4=7,7 ; pKa(HSO4-/SO42-)=2 corrigé |
||||||||||||||||||||
|
Le pôle positif est du côté de PbO2.
H2SO4 + H2O -->HSO4- + H3O+ ........1 mol ..................1 mol .....1 mol . HSO4- + H2O -->SO42- + H3O+. ..1-.x mol ..................x mol .....x mol total 1+ x mol ion H3O+ Ka = 10-2 = [SO42-][H3O+] / [HSO4-] conservation de l'élément soufre : [SO42-] + [HSO4-] = 1 d'où 0,01 = x(1+x) / (1-x)--> x=9,8 10-3 [SO42-] =9,8 10-3 mol L-1.[H3O+] =1,0098 mol L-1 produit de solubilité : [SO42-] [Pb2+] = Ks = 10-7,7= 2 10-8. [Pb2+] = 2 10-8 / 9,8
10-3 =2 10-6 mol L-1.
E1= 1,46 + 0,03 log (1,00984 / 2 10-6 )=1,63 V au pôle négatif : E2=-0,13 + 0,03 log 2 10-6= -0,3 V fem E=1,63 -(-0,3) = 1,93V
oxydation de Pb2+ en PbO2 à l'anode positive : Pb2+ + 2H2O -->PbO2 + 4H+ + 2e-. réduction de Pb2+ en Pb(s) à la cathode négative : Pb2+ + 2e---> Pb(s) prise en compte du précipité :Pb2+ + SO42- en équilibre avec PbSO4. bilan : 2PbSO4+ 2H2O -->PbO2 + 4H+ + Pb(s) + 2SO42- |
|||||||||||||||||||||
|
Pour chacune des piles suivantes indiquer la fem initiale, les pôles et la réaction quand la pile débite.
Données: E° (F2 / F-) = 2,87 V ; E° (Li+ / Li) = - 3,05 V ; E° (Fe3+ / Fe2+ ) = 0,77 V ; E° (Ag+ / Ag ) = 0,80 V corrigé couple Fe3+ / Fe2+ : Fe3+ +e- = Fe2+ ; E1=E° (Fe3+ / Fe2+ ) +0,06 / 1 log([Fe3+]/[Fe2+]) E1= 0,77 + 0,06 log (0,1/0,1)= 0,77 V . couple Ag+/Ag : Ag+ + e- = Ag(solide) : E2= E° (Ag+ / Ag ) +0,06 log [Ag+] l'activité de Ag (solide) vaut 1 ; de ce fait Ag n'apparaît pas dans la relation de Nernst E2= 0,8 + 0,06 log 0,01 = 0,68 V E1>E2 : le couple Fe3+ / Fe2+ constitue la borne positive; Fe3+ se réduit en Fe2+ Fe3+
+Ag = Fe2+ + Ag+. fem initiale :
0,77-0,68= 0,11 V.
E1= -3,05 + 0,06 log 0,1 = -3,11 V couple F2/F- : F2 + 2e- = 2F- : E2 =E° (F2 / F-) + 0,06/2 log(P2F2 / [F-]2) la pression des gaz est en bars. E2 = 2,87 + 0,03 log (1/0,12)= 2,93 V E2>E1 :le couple F2/F- constitue la borne positive ; F2 se réduit en F- ½F2 + Li = F-+Li+ ; fem initiale 2,93 - (-3,11) =6,04V |
|||||||||||||||||||||
|
Déterminer le potentiel que prend une électrode :
corrigé Cr2O72- +14 H+ + 6e- = 2Cr3+ + 7H2O E= E° (Cr2O72- / Cr3+) + 0,06/6 log([Cr2O72-][H+]14/[Cr3+]2) E= 1,33 + 0,01 log(0,01*0,0114 / 0,42)=1,038 V si la
concentration en soluté apporté est 0,2 mol/L
pour le sulfate de chrome III
Cr2(SO4)3 alors
[Cr3+]= 0,2*2= 0,4 mol/L
E= E° (Cl2 / Cl-) + 0,06/2 log (PCl2 / [Cl-]²) avec pression PCl2 en bar E= 1,36 + 0,03 log (0,5/ 0,02²)=1,45 V
|
|||||||||||||||||||||
|
On considère la pile schématisé par : Pt | Hg2+ , Hg2 2+ || Sn4+ , Sn2+ | Pt [Hg2+]0 = 1 mol.L-1 , [Hg2 2+]0 = 0,01 mol.L-1 , [Sn2+]0 = 1 mol.L-1, [Sn4+]0 = 0,01 mol.L-1 E° (Hg2+/ Hg2 2+) = 0,91 V ; E° (Sn4+/ Sn2+) = 0,15 V Les solutions des deux compartiments ont le même volume de 50 mL.
corrigé couple du mercure : 2 Hg2+ + 2e- = Hg2 2+ E1 = E° (Hg2+/ Hg2 2+) + 0,06/2 log([Hg2+]2/[Hg2 2+]) E1 = 0,91 + 0,03 log (1²/ 0,01)= 0,97 V couple de l'étain : Sn4+ + 2e- = Sn2+ E2 = E° (Sn4+/ Sn2+) + 0,06/2 log([Sn4+]/[Sn2+]) E2 = 0,15 + 0,03 log(0,01/1)=0,09 V fem E = 0,97-0,09 = 0,88 V ; E1 >E2 : le couple du mercure constitue la borne positive Hg2+ se réduit. 2 Hg2+ +Sn2+ = Sn4+ + Hg2 2+ DG= -nFE = -2 *96500*0,88 = -1,69 10 5 J/mol DG = -RT ln k ln k= 1,69 10 5 / (8,31*298)=68,6 ; k = 6 1029. la pile est usée lorsqu'au moins l'un des réactifs a disparu :
[Hg2+] =0 ; [Sn2+] = 0,025/0,05 = 0,5 mol/L ; [Sn4+] = [Hg2 2+ ]=0,0255/0,05 = 0,51 mol/L
|
|||||||||||||||||||||
|
|
On considère la pile schématisée par : Ag | Ag+ || Zn2+ | Zn La concentration d'ions Ag+ est de 0,18 mol/L et celle des ions Zn2+ de 0,30 mol/L.
Données: E°(Ag+ / Ag) = 0,80 V ; E°(Zn2+ / Zn) = - 0,76 V. corrigé Ag+ + e- = Ag(s) E1 = 0,8 + 0,06 log ([Ag+])=0,8 + 0,06 log 0,18 = 0,755 V Zn2+ + 2e- = Zn(s) E2= -0,76 + 0,06/2 log [Zn2+]= -0,76 + 0,03 log 0,3 = -0,775 V E1 >E2 donc argent pôle positif , Ag+ se réduit en Ag et le zinc s'oxyde en Zn2+. Zn + 2Ag+ = Zn2+ + 2Ag fem E= 0,755 -(-0,775) = 1,53 V sens conventionnel du courant à l'extérieur : du plus vers le moins les électrons vont en sens contraire, du zinc vers l'argent. DG = -n F E= -2*96500*1,53 = -295290 J/mol DG = - RT ln K ln K= 295920 / (8,31*298)=119,2 ; K= 6 10 51. La pile est usée lorsqu'au moins l'un des réactifs a disparu :
|
||||||||||||||||||||
|
|
On considère la pile schématisée par : (pôle -) Ag | Ag+ + NO3- + K+ + CN- || Ag+ + NO3- | Ag (pôle +) On introduit dans le compartiment de gauche d'abord 4 10-3 mole de nitrate d'argent puis 4 10-2 mole de cyanure de potassium. On assiste alors à la complexation des ions Ag+ par les ions CN- (complexe formé [Ag(CN)2]- ). Dans le compartiment de droite on introduit 4 10-2 mole de nitrate d'argent. La fem mesurée est alors de 1,08 V.
corrigé à gauche : E1 = 0,8 + 0,06 log ([Ag+]) à droite : E2 = 0,8 + 0,06 log ([Ag+]) = 0,8 + 0,06 log 0,04= 0,716 V E=1,08 = E2-E1 = 0,716-(0,8+0,06 log [Ag+]) 0,06 log [Ag+]= -1,08-0,8+0,716 = -1,164 log [Ag+]= - 19,4 ; [Ag+]= 4 10-20 mol presque tout disparu Ag+ + 2CN-=[Ag(CN)2]- il reste alors 0,04- 0,004*2 = 0,032 mol CN- il s'est formé pratiquement 0,004 mol de complexe constante de formation du complexe : K= [[Ag(CN)2]-]/ ([Ag+][CN-]²) Kformation = 0,004/((0,032)²*4 10-20)= 9,7 1019.
|
||||||||||||||||||||
|