|
|
|||
|
|||
|
. |
Une certaine quantité de gaz occupe un volume V1 de 5 mètres cube à la pression P1 =0,75.105 Pa et à la température T. L'enceinte contenant le gaz est réduite à un volume V2=1.5mètres cube, la température étant maintenue constante.
corrigé |
||
|
départ : P1=0,75 105 Pa; V1= 5 m3 fin : P2 V2= 1,5 m3 5*0,75 105 = 1,5* P2 P2 = 5*0,75 105/ 1,5 = 2,5 105 Pa = 2,5 bars
|
|||
|
Gaz sous forte pression |
Une bouteille d'acier de volumeV1=30L, dont le fond est un disque plat de rayon R=20cm, contient un gaz sous la pression P2=5 bars.
corrigé |
||
|
surface : 0,2*0,2*3,14= 0,1256 m² pression : 5 105 Pa force = 5 105 * 0,1256 = 62800 N. placer un manomètre à la sortie de la bouteille. départ : P1=5 105 Pa; V1= 0,03 m3 fin : P2=2 105 Pa; V2 0,03*5 105 = 2 105 * V2 V2 = 0,03*5 105/ 2 105 =0,03*5/2 =0,075 m3 = 75 L
|
|||
|
3 flacons et 2 robinets |
Trois flacons de volume V1=5 L ,V2=2 L ,V3=1 L sont reliés par l'intermédiaire de tuyaux de volume négligeable, munis de robinets . Au départ, les robinets R1 et R2 sont fermés. Seul le flacon de volume V1 contient un gaz sous la pression P1=2.105Pa, les deux autres flacons étant vides. La température du gaz est supposée constante pendant l'expérience.
corrigé |
||
|
V1= 0,005 m3 après ouverture de R1 : P2 V2= (5+2)10-3 m3 0,005*2 105 = 0,007* P2 P2 =0,005*2 105 / 0,007 = 5*2 105 / 7 =1,428 105 Pa = 1,428 bars la pression est la même dans les deux flacons départ : P1=2 105 Pa; V1= 0,005 m3 après ouverture de R1 et R2 : P3 V3= (5+2+1)10-3 m3 0,005*2 105 = 0,008* P3 P3 =0,005*2 105 / 0,008 = 5*2 105 / 8 =1,25 105 Pa = 1,25 bars la pression est la même dans les trois flacons
|
|||
|
marmite |
La soupape d'une marmite à pression est constituée par un piston de 8 mm de diamètre maintenu par un ressort. Elle laisse échapper la vapeur quand l'intensité atteint 3,5 N. 1. Calculer la pression maximale de la vapeur dans la marmite. corrigé |
||
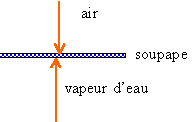
pression (pascal) exercée sur la soupape = force pressante (N) divisée par la surface soupape (m²) surface = 3,14 * 4*4 10-6 = 5,024 10- 5 m² pression (Pa) = 3,5 / 5,024 10- 5 = 6,9 104 pascal ou 0,69 bar la pression intérieure est donc supérieure de 0,69 bar à la pression atmosphérique extérieure (soit 1,69 bar)
|
|||
|
bulle de gaz |
Si une bulle de gaz se détache du fond d'un lac et monte à la surface: 1. Pourquoi la bulle monte? 2. Comment varie sa pression, température, volume
et force ascensionnelle? corrigé |
||
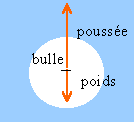
la bulle de gaz est soumise à son poids et à la poussée d'Archimède : or la masse volumique du gaz étant bien inférieure à la masse volumique du liquide (l'eau) , la pousseé est supérieure au poids : la bulle monte. poids = masse *9,8 = volume de la bulle fois masse volumique gaz * 9,8 poussée = poids du volume d'eau déplacé = volume de la bulle fois masse volumique eau * 9,8
dans l'eau la pression augmente de 1 bar tous les 10 m de profondeur: la pression du gaz diminue lors de la montée. en général la température est plus froide au fond du lac qu'à la suface volume gaz = nRT/P relation des gaz parfaits si T augmente et si P diminue alors le volume de la bulle augmente lors de la montée force ascensionnelle = poussée - poids= volume *9,8 ( 1000 - masse volumique gaz) la force ascensionnelle étant proportionnelle au volume, celle ci va augmenter.
|
|||
|
|
|||