|
|
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
propane |
Soit la combustion complète du propane C3H8 dans le dioxygène donnant du dioxyde de carbone et de l'eau.
corrigé |
||||||||||||||||||||||||||||||||||||||||
soit 2-x =0 --> x=2 mol soit 7-5x = 0 --> x=1,4 mol on retient la plus petite valeur: elle correspond à l'avancement maximal Le propane est en excès et la réaction s'arrète lorsque tout le dioxygène est consommé. la composition finale du mélange est donnée par la dernière ligne du tableau.
avancement maximal : l'un au moins des réactifs a disparu soit 1,5-x =0 --> x=1,5 mol soit 7,5-5x = 0 --> x=1,5 mol valeur identique: elle correspond à l'avancement maximal Le propane est le dioxygène sont en proportions stoéchiomètriques
|
|||||||||||||||||||||||||||||||||||||||||
|
soufre |
L'une des étapes de la synthèse de l'acide sulfurique est la réaction entre le sulfure d'hydrogène H2S et le dioxyde de soufre SO2. Le soufre S et l'eau sont les produits de cette réactiion.
corrigé |
||||||||||||||||||||||||||||||||||||||||
soit 5-2x =0 --> x=2,5 mol soit 4-x = 0 --> x=4 mol on retient la plus petite valeur: elle correspond à l'avancement maximal SO2 est en excès et la réaction s'arrète lorsque tout H2S est consommé. la composition finale du mélange est donnée par la dernière ligne du tableau.
soit 3,5-x =0 --> x=3,5 mol et n-2 x = 0 --> n =2x = 7 mol
|
|||||||||||||||||||||||||||||||||||||||||
|
éthanol |
On considère la combustion complète de l'éthanol C2H6O dans le dioxygène. Les seuls produits sont le dioxyde de carbone et l'eau.
corrigé |
||||||||||||||||||||||||||||||||||||||||
|
les quantités de matière (mol) des réactifs initiaux sont stoéchiométriques. à partir de 0,2 mol d'éthanol, 3 *0,2 = 0,6 mol de dioxygène sont nécessaires. On obtient alors : 2 *0,2 = 0,4 mol CO2 et 3 *0,2 = 0,6 mol H2O soit en masse : 0,4*(12+16*2) = 17,6 g CO2 et 0,6 (2+16) = 10,8 g d'eau. volume de dioxygène : 0,6 * 25 = 15 L Quantités initiales des réactifs : alcool ( masse molaire : 2*12+6+16 )= 46 g/mol) : 2,3 /46 = 0,05 mol dioxygène : 1,5 / 25 = 0,06 mol
soit 0,05-x =0 --> x=0,05 mol soit 0,06-3x = 0 --> x=0,02 mol on retient la plus petite valeur: elle correspond à l'avancement maximal C2H6O est en excès et la réaction s'arrète lorsque tout O2 est consommé. la composition finale du mélange est donnée par la dernière ligne du tableau.
|
|||||||||||||||||||||||||||||||||||||||||
|
étude graphique |
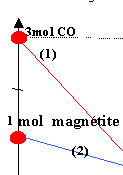
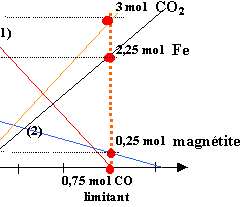
Le graphe ci dessous représente l'évolution, en fonction de l'avancement de la réaction x, des quantités de matière des réactifs et des produits d'une réaction se produisant dans le haut fourneau. Les réactifs sont la magnétite Fe3O4, le monoxyde de carbone CO; les produits sont le fer et le dioxyde de carbone.
corrigé |
||||||||||||||||||||||||||||||||||||||||
|
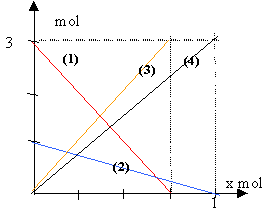
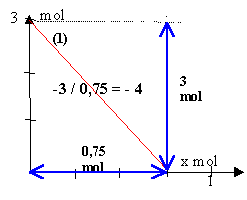
coefficient directeur
de même pour les autres droites : (2) donne -1 / 1 = -1 (3) donne : 3 / 0,75 = 4 ; (4) donne : 3/1 = 3 les valeurs absolues des coefficients directeurs correspondent aux nombres stoéchiométriques. composition initiale : produits : 0 mol réactifs :
composition finale :
CO : entirement consommé : l'avancement maximale correspond à 0,75 mol
|
|||||||||||||||||||||||||||||||||||||||||
|
Fe(OH)3 |
A 4,0 mL de solution de chlorure de fer (III) ( [Fe3+] =0,10 mol.L-1 ), on ajoute 8,0 mL de solution de soude ([OH- ]= 0,70 mol.L-1 ) .Les ions Fe3+ réagissent avec les ions OH- pour donner un précipité d'hydroxyde de fer (III).
corrigé |
||||||||||||||||||||||||||||||||||||||||
|
concentration (mol /L) fois volume (L) = quantité de matière (mol) initial : Fe3+ : 4 * 0,1 = 0,4 mmol ou 4 10-4 mol HO- : 8* 0,7 = 5,6 mmol
soit 5,6 - 3 x =0 --> x=1,86 mmol soit 0,4- x = 0 --> x=0,4 mmol on retient la plus petite valeur: elle correspond à l'avancement maximal HO- est en excès et la réaction s'arrète lorsque tout Fe3+ est consommé. la composition finale du mélange est donnée par la dernière ligne du tableau. concentrations : diviser par le volume total : 12 mL [HO-]= 4,4 / 12 = 0,366 mol/ L et zéro pour l'ion fer III
|
|||||||||||||||||||||||||||||||||||||||||
|
AlCl3 |
On veut obtenir 10g de trichlorure d’aluminium à partir d’aluminium et de dichlore. Quelle masse d’aluminium et volume de dichlore doit-on prendre au minimum au départ ? Al=27 ; Cl=35 g/mol ; volume molaire : 24 L/mol corrigé Al +1,5 Cl2= AlCl3
masse molaire trichlorure d'aluminium : 27+3*35,5 = 133,5 g/mol masse (g) / masse molaire (g/mol) = 10/133,5=0,075 mol AlCl3. conditions stoéchiométriques : donc 0,075 mol Al : 0,075*27= 2g. donc 1,5*0,075 = 0,112 mol Cl2 : volume molaire (gaz) * Qté de matière (mol) = 0,112*24 = 2,7L.
|
||||||||||||||||||||||||||||||||||||||||
|
Fe2O3 |
On prend 8g de fer et 1,8L de dioxygène pour obtenir l’oxyde de fer III. Déterminer le réactif limitant ? Quelle masse d’oxyde de fer obtient-on ? Fe = 56 ; O=16 g/mol ; volume molaire : 24 L/mol corrigé
0,143-2xmax=0 soit xmax= 0,072 mol masse d'oxyde : Qté de matière (mol) * masse molaire (g/mol) = 0,05*(2*56+3*16)= 8g. |
||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||