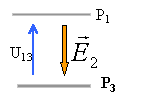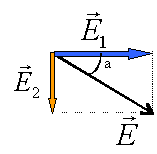|
champs- acide et base forts- cinétique
|
||||||
|
champ magnétique
|
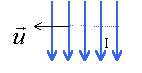
Soit un solénoïde de longueur L, comprenant N= 50 spires. Le diamètre du solénoïde est suffisamment petit devant sa longueur pour qu'on puisse le considérer comme infiniment long. Le solénoïde est parcouru par un courant I= 2,5 A dans le sens indiqué sur le schéma. perméabilité magnétique du vide m0=4p 10-7 SI Répondre par vrai ou faux en justifiant .
corrigé Le sens du champ magnétique dépend du sens du courant : règle de l'observateur d'Ampère : L'observateur est allongé sur le fil , le courant entre par les pieds; il regarde vers l'intérieur de la bobine; son bras gauche tendu indique le sens du champ.
n=50/0,5 = 100 spires par mètre B = 4*3,14 *10-7*100 *
2,5 = 3,14 10-4 T
En conséquence le champ ne
change pas
|
|||||
|
|
||||||
|
champ électrique dans une cage |
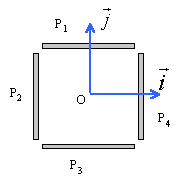
Quatre plaques métalliques P1, P2, P3, P4 forment sans se toucher une cage rectangulaire parallélépipédique.On appelle O le centre de symétrie de l'ensemble auquel on associe le repère (Ox,Oy) . La distance qui sépare P1 et P3 ou P2 et P4 est d=2,5 cm.
|
|||||
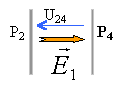
norme de E1 égale U24 divisée distance des plaques en mètres 150 / 0,025 = 6 000 V m-1.
norme de E2 égale U13 divisée distance des plaques en mètres 100 / 0,025 = 4 000 V m-1.
E²=E1²+E2² soit E= 7200 V m-1. tan a= 4000 / 6000 = 0,666 et a = 33,7 °
|
||||||
|
cinétique |
Le pentaoxyde de diazote N2O5 se décompose par chauffage selon la réaction d'équation bilan : 2 N2O5 --> 4 NO2 + O2. Un récipient initialement vide de volume 12 L est rempli avec du pentaoxyde de diazote à 20 ° jusqu'a ce que la pression atteigne 1 bar puis il est ensuite chauffé à 16O°. Les réactifs et les produits sont tous gazeux. La réaction est quantitative. A 20° sous la pression de 1 bar, le volume molaire des gaz est 24 L mol-1. Répondre par vrai ou faux en justifiant.
L'évolution au cours du temps de la quantité de matière de pentadioxyde de diazote présente dans le récipient est donnée par la courbe suivante: 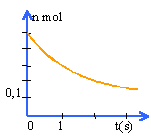
corrigé |
|||||
|
A partir de 0,5 mol de N2O5 il se formae 1 mol de NO2 et 0,25 mol de O2. Après réaction le récipient contient 1,25 mol de gaz. la vitessse d'une réaction augmente avec la température. Une vitesse de réaction est toujours positive. 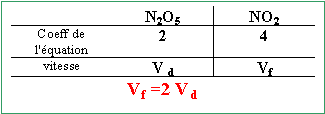
|
||||||
|
acide fort dosage |
On prépare 500 mL d'une solution d'acide bromhydrique en dissolvant du bromure d'hydrogène HBr dans de l'eau distilée. Le pH de la solution obtenue est 2. Lors d'un dosage d'un prélevement de 20 mL de solution par la soude à 0,02 mol/L, le volume équivalent est 10 mL. répondre par vrai ou faux en justifiant
corrigé |
|||||
|
H3O+ + HO- --> 2H2O A l'équivalence la quantité de matière d'acide (mol) est égale à la quantité de matière d'ion hydroxyde (mol). CAVA = CBVB CA=0,02*10 /20 =0,01 mol L-1. Nous constatons que pour la solution d'acide bromhydrique pH=-log c est bien vérifiée. Cet acide est, comme l'acide chlorhydrique un acide fort. Le pH à l'équivalence lors du dosage acide fort base fort est voisin de 7. La zone de virage de l'indicateur coloré doit contenir le pH de la solution à l'équivalence. 0,01 mol d'acide par litre de solution. Pour obtenir seulement 0,5 L de cette solution il a fallu dissoudre 0,005 mol de gaz HBr dans 0,5 L d'eau. Soit en volume : 0,005 * 25 = 0,125 L = 125 mL de gaz HBr. |
||||||
|
mélange d'acides forts |
On mélange 100 mL d'acide chlorhydrique de pH=1 à 200 mL d'acide sulfurique de pH=2.
corrigé |
|||||
|
concentration de la solution d'acide chlorhydrique : 0,1 mol L-1. soit 0,01 mol d'ion hydronium dans 100 mL. concentration de la solution d'acide sulfurique : 0,01 mol L-1. soit 0,002 mol d'ion hydronium dans 200 mL. au total : 0,012 mol d'ion hydronium dans 300 mL [H3O+] = 0,012 / 0,3 = 0,04 mol L-1. pH=-log (0,04) = 1,4 . |
||||||
|