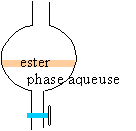|
divers préparations d'un ester .
|
||||||||||||||||||||||
|
acide et chlorure d'acyle densité rendement |
But: comparer plusieurs méthodes de préparation de l'éthanoate de pentyle. Acide éthanoique + pentan-1-ol ou bien chlorure d'éthanoyle + pentan-1-ol. Dans les 2 cas le mélange est équimolaire.
|
|||||||||||||||||||||
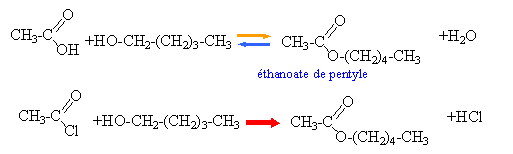
quantité de matière : alcool : masse 50*0,81 = 40,5 g ; 40,5 / 88 = 0,46 mol acide : 0,46 mol ; masse : 0,46*60 =27,6 g ; volume 27,6 / 1,05 = 26,3 mL chlorure d'acyle : 0,46 mol ; masse : 0,46*78,5 =36,1 g ; volume 36,1 / 1,11 = 32,5 mL les volumes sont mesurés à l'aide d'une pipette jaugée surmontée d'un pipeteur l'acide sulfurique est un catalyseur la pierre ponce régularise l'ébullition le chlorure d'acyle doit être manipulé sous hotte (vapeurs noçives) et ajouté lentement en refroidissant ( la réaction étant exothermique) à partir de 0,46 mol d'alcool on peut théoriquement obtenir 0,46 mol d'ester masse molaire de l'ester : 130 g/mol soit une masse théorique d'ester égale à : 130*0,46 = 59,8 g rendement (réaction 1) 30/59,8 = 0,5. à partir ddu mélange équimolaire d 'un alcool primaire et d'un acide carboxylique, le rendement est de 0,67 lorsque l'équilibre est atteint. rendement (réaction 2) 52/59,8 = 0,87. la réaction (2) est totale
de deux liquides non miscibles la phase la plus dense occupe la partie inférieure l'ester, liquide le moins dense, occupe la partie supérieure
|
||||||||||||||||||||||
|