| |
estérification et hydrolyse.
|
||||||||||
|
|
estérification hydrolyse |
Le texte suivant décrit les expériences réalisées par BERTHELOT et PEAN DE SAINT-GILLES sur les réactions d’estérification et d’hydrolyse. “ Les expériences consistent en général à introduire les substances que l’on fait réagir dans des vases scellés, à les chauffer à une température déterminée pendant un temps plus ou moins long, à analyser les produits, enfin à calculer les résultats de l’analyse... Dans tous les cas de ce genre, le produit final se compose des mêmes corps... Mais ces corps sont dans des proportions telles qu’il suffit de déterminer exactement la masse d’un seul d’entre eux, à un moment quelconque des expériences, pour en déduire toutes les autres, pourvu que l’on connaisse les masses des matières primitivement mélangées. C’est évidemment l’acide qu’il faut déterminer, car l’acide se prête à des dosages plus rapides et plus précis qu’aucun autre composant... On transvase le produit final dans un vase à fond plat, on ajoute quelques gouttes de teinture de tournesol, et l’on verse l’eau de baryte (solution d’hydroxyde de baryum : Ba 2+ + 2 OH - ) avec une burette graduée jusqu'à ce que la teinte rose ou violacée du tournesol ait viré au bleu franc... Si l’on élimine l’eau, la réaction d’un acide sur un alcool, à quantités de matière égales, peut atteindre un rendement de 100 %.”
La réaction d’estérification
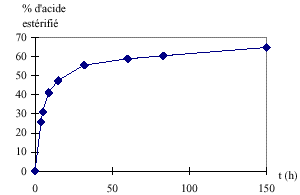
Pourcentage d’acide estérifié
Etude des vitesses de réaction
|
|||||||||
| |
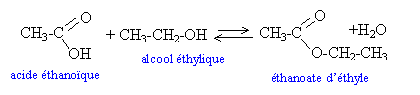
Il parle de l’ensemble des espèces chimiques présentes à l’équilibre. L’acide éthanoïque et l’éthanol non estérifiés ainsi que l’éthanoate d’éthyle et l’eau formés. n(acide éthanoïque) = n0 - x n(éthanol) = n0 - x n(ester) = x n(eau) = x dosage : Erlenmeyer contenant le mélange et la teinture de tournesol Burette graduée contenant l’eau de baryte CH3COOH + HO- donne CH3COO- + H2O A l’équivalence la quantité d’acide dosé est égale à la quantité d’ions OH- versée n(acide dosé) = n(OH-) Puisque Ba(OH)2 donne Ba2+ ++ 2 OH- alors n(OH-) = 2CV et n(acide dosé) = 2CV n(acide estérifié) = n0 - 2CV
vitesse :
La vitesse de formation de l’ester diminue au cours du temps car la quantité de réactifs diminue au cours du temps. Le temps mis pour atteindre un pourcentage donné d’acide estérifié est plus grand à température ambiante qu’à 100°C. On peut en conclure que la température est un facteur cinétique. Une augmentation de température permet d’atteindre plus rapidement l’état d’équilibre. On pourrait ajouter un catalyseur. L’acide sulfurique par exemple. Lorsqu’on élimine l’eau, il n’y a plus de réaction d’hydrolyse et donc la réaction d’estérification n’est plus limitée. Le rendement peut alors atteindre 100%.
|
||||||||||
|
|
|