| |
aspirine Inde 99
|
||||||
|
|
couples acide base dilution dosage
|
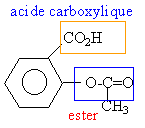
Extrait du dictionnaire des «médicaments conseil grand public »concernant l ’Aspirine du Rhône 500. Disponible sous deux formes :– comprimé en boîtes de 30 ou de 100 comprimés,– comprimé à croquer, ambulatoire et facile à transporter. Composition par comprimé :– acide acétylsalicylique : 500 mg,– excipient : amidon de blé, gel de silice. Données :masses molaires atomiques :(g/mol) C=12; H=1; O=16.. L ’aspirine ou acide acétylsalicylique Ce corps a pour formule simplifiée la formule ci-dessous. 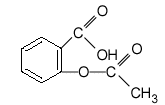 Sa masse molaire moléculaire est de180 g/mol.
Dosage On veut doser 100 mL de la solution S1 par une solution d’hydroxyde de sodium de concentration C2 =0,05 mol/L .
|
|||||
| |
concentration théorique de la solution S1 : quantité de matière d'aspirine : 0,5 / 180 = 2,77 10-3mol C1 = [aspirine]=2,77 10-3/0,5 =5,55 10-3mol / L dosage : AH+HO- donne A- + H2O Kr = [A-] / ([AH][HO-] )= [A-] [H3O+] / ([AH][HO-][H3O+] ) Kr = 10-3,5 / 10-14 = 1010,5. La réaction est totale ( Kr > 104 ) . Elle peut être utilisée pour un dosage. A l'équivalence le milieu contient la base faible A- : le pH est donc supérieur à 7. A l'équivalence CaVa=CbVb Ca = 0,05*10,9 / 100 Cex = 5,45 10-3 mol /L 2% inférieur à la valeur théorique C1(5,56 10-3). explication possible de cet écart de 2%: erreur sur la concentration de la solution de soude erreur lors de la mesure des volumes . saponification : la soude peut saponifier lentement l'ester à froid, plus rapidement à chaud. en travaillant rapidement et à froid, seule la réaction acide base est à prendre en compte.
|
||||||
|
|
|