| |
fabrication d'un savon .
|
||||||
|
|
saponification rendement
|
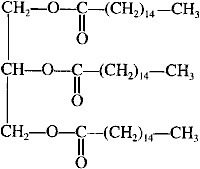
La saponification. Les corps gras débarrassés de leurs impuretés, additionnés d'une quantité donnée de base forte, sont envoyés par un mélangeur dans une cuve ouverte (contenance de l'ordre de 50 tonnes), puis chauffés à la vapeur. La cuve est remplie progressivement afin que le brassage du liquide reste toujours énergique. L'addition d'eau et de sel facilite le traitement du mélange. Un peu avant la fin de l'opération, on augmente le jet de vapeur afin d'intensifier le brassage. A la fin du traitement, on obtient du savon contenant du sel et du glycérol. Elimination du glycérol ou relargage. Le savon est chauffé avec plusieurs tonnes de saumure chaude (eau très salée). Dans l'eau salée, le glycérol est très soluble tandis que le savon l'est beaucoup moins. A la partie supérieure du mélange, se rassemblent des grumeaux de savon, alors qu'à la partie inférieure, il est possible de soutirer la " lessive " formée de saumure et de glycérol. La liquidation. Les grumeaux de savon contenant du sel sont chauffés avec de l'eau. Après repos pendant quelques jours, trois couches se forment : au-dessus le savon pur (qui peut être récupéré), puis uns substance moins riche en savon et enfin de l'eau avec des traces de glycérol et de sel. Saponification d'un ester.
Fabrication d'un savon.
corrigé |
|||||
| |
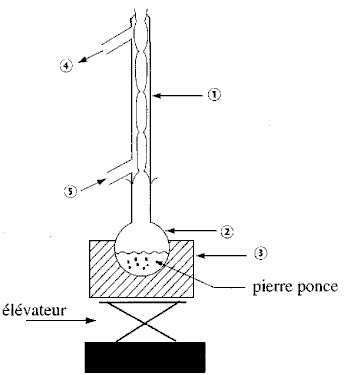
R'-COOR + HO- + Na+ donne R'-COO- + Na+ + ROH ester ..........soude..........carboxylate de sodium ...alcool réaction lente et totale à température ambiante. l'atome d'oxygène de l'ion hydroxyde est riche en électrons, c'est un site nucléophile. l'atome de carbone du groupe fonctionel ester est appauvri en électrons, c'est un site électrophile. dans le texte, les triesters sont appelés corps gras. palmitate de glycéryle + 3(Na+ + HO-) donne CH2OH-CHOH-CH2OH glycérol et 3 CH3-(CH2)14-COO- + 3Na+ réfrigérant à eau (1); ballon (2); chauffe ballon (3) l'eau entre en (5) et sort en (4) La température est un facteur cinétique : la vitesse de la réaction croît lorsque la température croît. relargage : le savon est insoluble dans l'eau salée, il précipite et est séparé des autres constituants du mélange réactionnel. filtration sous vide rendement : 10 t = 10 000 kg = 107 g quantité de matière (mol) de triester : 107 / 806 = 12407 mol donc 3*12407 = 37220 mol de savon masse molaire du savon : 12*16+31+2*16+23= 278 g / mol masse de savon : 37220*278 = 10,347 t en tenant compte du rendement : 10,347 *0,85 = 8,8 tonnes. |
||||||
|
|
|