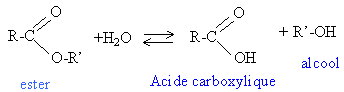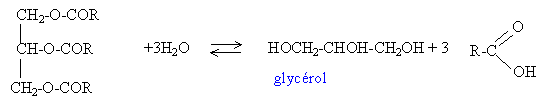| |
altération des huiles France bac 09 / 2000
|
||||||
|
|
hydrolyse d'un ester dosage acide base
|
Les huiles utilisées comme liant en peinture par les artistes peintres sont des triglycérides. Ces triglycérides réagissent au cours du temps avec l’eau pour donner du glycérol et les acides gras correspondants. Dans cet exercice, on se propose d’étudier l’altération au cours du temps d’une huile de lin et de caractériser son vieillissement par son indice d’acide noté I.A. La connaissance de cet indice permet de mieux préserver les tableaux réalisés à la peinture à l’huile. Un triglycéride est un triester du glycérol ou propan-1,2,3-triol et d’un acide gras. Un acide gras est un acide carboxylique, noté RCO2H à longue chaîne carbonée notée R. Les principaux acides gras constituant l’huile de lin étudiée ici sont l’acide oléique (C17H33CO2H) et l’acide linolénique (C17H29CO2H). La potasse solide a pour formule KOH ; sa masse molaire vaut M = 56 g.mol -1 . Sa solution alcoolique contient notamment les ions potassium K + et hydroxyde HO - . Origine de la dégradation d’un triglycéride
Détermination de l’indice d’acide d’une huile de lin partiellement dégradée L’huile de lin partiellement dégradée contient donc une certaine quantité d’acides gras libres provenant de sa dégradation par l’eau. On se propose de déterminer la quantité d’acide gras dans une vieille huile de lin. Une solution est préparée en introduisant, dans un becher m1 = 10,0 g d’huile dissoute dans de l’éthanol. On dose à froid les acides gras libres, contenus dans cette solution, par une solution de potasse alcoolique de concentration Cb = 0,1 mol.L -1 , en présence de phénolphtaléine. La réaction de dosage en solution alcoolique a les mêmes propriétés qu’en solution aqueuse. Le volume de la solution de potasse nécessaire pour obtenir l’équivalence est Vb = 15,2 mL. On néglige les autres réactions qui pourraient avoir lieu dans le milieu.
|
|||||
| |
réaction du dosage : totale et rapide R-COOH + HO- donne RCOO- + H2O à l'équivalence du dosage acide base, les quantités de réactifs mises en présence sont proportionnelles aux coefficients de l'équation bilan. Quantité de matière acide (mol) = Quantité de matière ion hydroxyde (mol) 0,1*15,2 = 1,52 mmol dans 10 g d'huile de lin ou 0,152 mmol dans 1 g d'huile de lin. masse de potasse correspondante masse molaire potasse KOH = 39+16+1 = 56 g /mol 0,152*56 = 8,512 mg Entre un acide gras et l'éthanol, peut se produire une réaction d'esterification: mais celle ci est très lente et n'a pratiquement pas le temps de modifier les quantités d'acide gras durant la durée du dosage acide base.
|
||||||
|
|
|