| |
dosage d'un comprimé de vitamine C Japon bac 06 /97
|
||||||
|
|
dosages acide fort base forte acide faible base forte
|
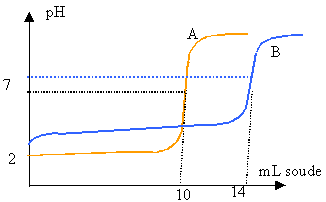
La manipulation décrite dans cet exercice a pour but de retrouver la teneur en acide ascorbique d'un comprimé de " Laroscorbine 500 " vendu en pharmacie. L'acide ascorbique est noté par la formule simplifiée AH. Le pH de l'eau distillée utilisée pour préparer les solutions est légèrement inférieur à 7. Mode opératoire Ce dosage s'effectue en deux étapes étalonnage de la solution de soude utilisée pour le dosage : On suit au pHmètre la réaction entre cette solution de soude et une solution titrée S1 d'acide chlorhydrique. On obtient une des 2 courbes ci après (courbe A ou courbe B). Le volume de la solution acide prélevé est V1=10 mL. La concentration de l'acide est C1=0,02 mol L-1. dosage de la solution d'acide ascorbique par la solution de soude étalonnée Un comprimé de " Laroscorbine 500 " est dissous dans un peu d'eau dans un bécher. Le contenu du bécher est transvasé dans une fiole jaugée de volume V=200 mL. On complète avec de l'eau distillée jusqu'au trait de jauge. On obtient une solution notée S2. On prélève un volume V2 = 20 mL de la solution S2 et on le verse dans un bécher propre. On suit au pHmètre la réaction entre la soude et l'acide ascorbique. La courbe obtenue est l'une des 2 courbes ci-après (courbe A ou courbe B)
Questions :
Masse molaire de l'acide ascorbique :176 g/mol Couples acide base auquels participe l'eau H3O+ / H2O pKa=0 ; H2O / HO- pKa =14
|
|||||
| |
pH initial égal à 2 soit très proche de -log [acide] forme de la courbe au départ pH=7 à l'équivalence courbe B : dosage acide faible base forte pH initial égal à 3 soit supérieur à -log [acide] (voir calculs ci après) forme de la courbe au départ pH supérieur à 7 à l'équivalence dosage de la soude H3O+ + HO- donne 2H2O Kr =1014. A l'équivalence : CaVa = Cb Vb Cb =0,02*10 / 10 = 0,02 mol L-1. à la demi équivalence du dosage acide faible base forte, le pH est égal au pKa du couple acide base faible. lecture graphique : Vb =7 mL et pH voisin de 4 soit Ka voisn de 10-4. AH + HO- donne A- + H2O H2O / HO- pKa = 14 AH / A- pKa = 4. on met en présence l'acide le plus fort d'un couple et la base la plus forte de l'autre couple. réaction naturelle dont la constante est supérieure à 1 faire la différence positive des pKa Kr = 10 (14-4) = 10 10. réaction totale, quantitative. A l'équivalence CaVa= Cb Vb Ca = 0,02*14 / 20 = 0,014 mol L-1. Soit 0,014*0,2 = 0,0028 mol dans le comprimé dissout dans 200 mL d'eau (fiole jaugée) 0,0028 * masse molaire vitamine C = 0,0028*176 = 493 mg. valeur proche de 500 mg ce qui justifie l'appellation "500".
|
||||||
|
|
|