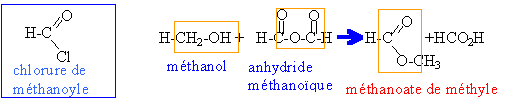| |
obtention du méthanoate de méthyle Inde bac avril 2000
|
||||||
|
|
esterification anhydride d'acide rendement
|
masses atomiques molaires g /mol : H=1 ; C=12 ; O=16 On étudie la réaction entre l'acide méthanoïque et le méthanol. Dans plusieurs récipients on mélange une masse m1 =2,3 g d'acide et une masse m2 = 1,6 gd'alcools. Les récipients sont scellés et placés dans une étuve à 50°C. Au bout de 24 heures on constate que la masse restante m =0,76 gd'acide est constante.
|
|||||
| |
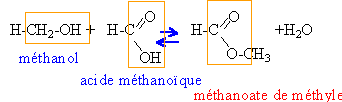
estérification: lente, athermique limitée par l'hydrolyse de l'ester rendement = masse réelle de l'ester*100 / masse théorique (réaction supposée totale) quantité de matière initiale alcool (masse molaire 32 g/mol): 1,6 / 32 = 0,05 mol acide (masse molaire 46 g/mol) : 2,3 /46 = 0,05 mol mélange équimolaire, la quantité théorique d'ester est 0,05 mol quantité de matière finale acide : 0,76 / 46 = 0,0165 mol acide ayant réagi : 0,05-0,0165 =0,0335 mol quantité d'ester formé : 0,0335 mol rendement 0,0335 *100 / 0,05 = 67% l'équilibre est atteint (mélange équimolaire et alcool primaire) En ajoutant l'un des réactifs de départ en excès, on déplace l'équilibre vers la formation de l'ester.
rapide, totale, exothermique. à partir de 0,5 mol d'alcool on obtient 0,05 mol d'ester soit 60*0,05 = 3g. 0,05 mol d'anhydride méthanoïque est nécessaire soit 0,05*74 =3,7 g.
|
||||||
|
|
|