| |
estérification et vitesse moyenne Polynésie bac juin 2000
|
||||||
|
|
ester rendement facteurs cinétiques
|
masses atomiques molaires g /mol : H=1 ; C=12 ; O=16 Dans un erlenmeyer sec on introduit 12 g de propan-1-ol et 12 g d'acide éthanoïque. On porte ce mélange à 100 °C avec un dispositif de chauffage à reflux, dont la température est alors maintenue constante.
|
|||||
| |
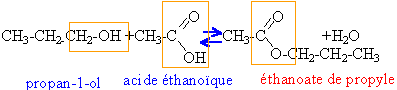
estérification : lente, athermique et limitée par l'hydrolyse de l'ester. chauffage : la température est un facteur cinétique, la vitesse de la réaction est beaucoup plus grande à 100°C qu'à 20°C à reflux : le réfrigérant à eau situé au dessus du ballon condense les vapeurs ; les gouttes liquides retombent dans le ballon: cela évite les pertes de matière. quantité de matière acide éthanoïque : masse molaire 60 g/mol 12/60 = 0,2 mol alcool propan-1-ol : masse molaire 60 g/ mol 12 /60 = 0,2 mol donc mélange équimolaire. ester, éthanoate de propyle : masse molaire 102 g/mol 7,4 /60 =0,1233 mol d'acide restant 0,2-0,1233 = 0,0766 mol d'acide ayant réagi en conséquence 0,0766 mol d'ester formé. Une trempe, refroidissement brutal de 100°C à quelques degrés réalise un blocage cinétique. Quantité d'ester formé au bout de 20 heures acide restant : 6,1/60 voisin 0,1 mol acide consommé : 0,2-0,1 =0,1 mol donc 0,1 mol d'ester, c'est à dire 50%. L'équilibre est atteint lorsqu'au départ d'un mélange équimolaire d'acide et d'alcool primaire , le rendement est 67%. Ici l'équilibre n'est pas encore atteint. vitesse moyenne =quantité d'ester formé divisée par la durée 0,07666 / 10 = 7,66 10-3 mol /heure 0,1/20 = 5 10-3 mol / heure Au bout de 20 heures la vitesse de formation de l'ester est plus faible car la concentration des réactifs a diminué. En utilisant un catalyseur (ion hydronium) on augmentera la vitesse de la réaction, sans pour autant modifier la composition du mélange à l'équilibre. Lorsque l'ester est le corps le plus volatil ( T ébullition la plus basse), on peut par distillation, enlever l'ester du mélange au fur et à mesure qu'il se forme. L'équilibre est alors déplacé dans le sens formation de l'ester. Ici cette méthode n'est pas applicable, ce n'est pas l'ester qui est le plus volatil. autre méthodes : ajouter l'un des réactifs en excès remplacer l'acide par un chlorure d'acyle ou une anhydride d'acide.
|
||||||
|
|
|