| |
un composant des eaux de toilettes : l'acétate de menthyl Polynésie bac 12/98
|
||||||||||||||||||||||||||
|
|
estérification extraction rendement
|
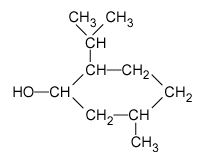
Présentation L’acétate de menthyle (ou éthanoate de menthyle), dérivé du menthol, fait partie des espèces couramment utilisées dans le domaine de l’élaboration d’un parfum : sa présence dans un parfum amplifie la touche « florale », spécialement la note « rose » que développent les eaux de lavande commerciales. Dans la nature, on le trouve dans l’huile essentielle extraite de la menthe poivrée (Mentha piperata). Il est difficilement isolable car associé à de nombreuses autres espèces. On se propose d’étudier une préparation de ce composé en laboratoire à partir d’acide acétique (ou acide éthanoïque) et de menthol, lui-même obtenu par synthèse. – Caractéristiques des réactifs et produits :
I Préliminaires
|
|||||||||||||||||||||||||
| |
le menthol est un solide à la température ambiante de 20°. Une réaction d'esterification est lente, athermique et limitée par l'hydrolyse de l'ester. Le menthol est noté R-CHOH-R' R-CHOH-R'+ CH3CO2H en équilibre avec CH3-CO2-CHRR' + H2O menthol : 10 / 156 = 0,064 mol acide éthanoïque : 10*1,05 / 60 = 0,175 mol l'acide et l'alcool réagissent mole à mole, en conséquence le menthol est le réactif limitant et l'acide acétique est en excès. On obtiendrait dans le cas d'une réaction totale :0,064 mol d'ester soit : 0,064*198 = 12,67 g. Rôle du chauffage Le chauffage élevant la température du mélange réactionnel augmente la vitesse de formation de l ’ester. Rôle du reflux On chauffe à reflux pour condenser les vapeurs formées et éviter ainsi les pertes de produits et de réactifs. Rôle de l ’acide sulfurique Il joue un rôle de catalyseur. Verrerie pour réaliser la séparation des deux phases On utilise une ampoule à décanter et deux béchers pour récupérer les 2 phases (un pour chaque phase). Rôle du lavage de la phase organique Dans la phase organique il peut rester de l ’acide éthanoïque. L ’hydrogénocarbonate réagit avec l ’acide éthanoïque suivant : CH3CO2H + HCO3- donne CH3-CO2- + CO2 + H2O En lavant la phase organique par une solution d ’hydrogénocarbonate de sodium,on fait réagir l ’acide éthanoïque restant en le transformant en ion éthanoate qui part avec l ’eau de lavage (les ions éthanoate sont très solu- bles dans l ’eau et peu solubles dans la phase organique). Le gaz responsable de l ’effervescence est le dioxyde de carbone CO2 qui se dégage lors de la réaction entre l ’acide éthanoïque et l ’ion hydrogénocarbonate. Rendement de la synthèse On obtient une masse d ’acétate de menthyle égale à 8,2 g Si la réaction avait totale on aurait obtenu une masse théorique d'ester de 12,627 g Le rendement de cette synthèse est : 8,2 / 12,67 *100 = 64,7%.
|
||||||||||||||||||||||||||
|
|
|