| |
comparaison d'acides faibles (Liban bac sept 99)
|
||||||
|
|
constante de réaction dosage acide faible base forte solution tampon
|
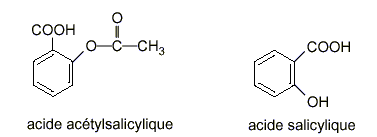
Étude de deux acides faibles : l'acide salicylique et
l'acide acétylsalicylique et comparaison de leurs forces relatives par
détermination des pKa des couples acide-base correspondants. Masse molaire de l’acide salicylique : 138 g / mol Masse molaire de l’acide acétylsalicylique : 180 g / mol Masses molaires atomiques en g / mol : Na = 23 : H=1 I – Étude d ’une solution d ’acide salicylique L’acide salicylique sera considéré comme un monoacide faible (on ne prend pas en compte l’acidité de la fonction phénol).
II – Étude d ’un mélange équimolaire d ’acide acétylsalicylique et d ’acétylsalicylate de sodium
III – Force relative de ces deux acides faibles À partir des résultats des expériences précédentes, comparer la force relative de ces 2 acides faibles.
|
|||||
| |
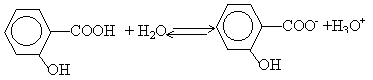
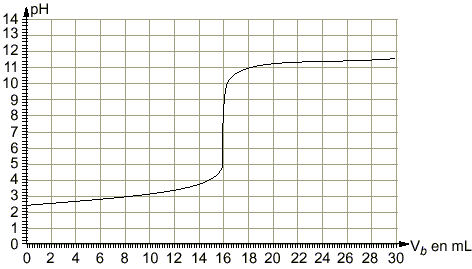
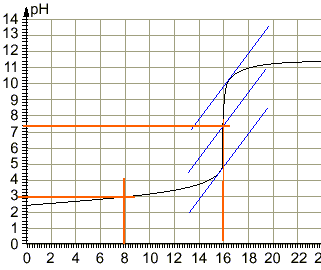
coordonnées du point d'équivalence :déterminées par la méthode des tangentes pH voisin de 7,4 et Vb=16 mL
le pH à la demi équivalence d'un dosage acide faible base forte est égal au pKa du couple acide base mis en jeu : pKa =3 équation bilan de la réaction de dosage : AH+HO- donne A- + H2O. H2O / HO- pKa=14 AH / A- pKa =3 on a mis en présence l'acide le plus fort d'un couple et la base la plus forte de l'autre couple : la constante de la réaction naturelle qui a lieu sera plus grande que 1. différence des pKa :11 constante de la réaction Kr =[A-] / ([AH] [HO-]) = 1011. (réaction totale) à l'équivalence acide base : Ca Va = Cb Vb Ca =0,015*16 / 25 = 0,0096 mol /L Quantité de matière d'acide acéthyle salicylique : 0,25 / 180 = 1,39 mmol masse molaire de l'acéthylsalicylate de sodium : 180-1+23 =202 g/mol m2 /202 =1,39 10-3 m2 = 281 mg. La solution préparée contient en quantité égale l'acide faible A2H et sa base conjuguée A2- : c'est une solution tampon. Le pH mesuré est dans ces conditions égal au pKa du couple acide base mis en jeu. Le pH d'une solution tampon varie peu par ajout modéré d'acide fort ou de base forte. Le pH d'une solution tampon ne varie pas par dilution (ou ajout d'eau) car les concentrations de de l'acide et de la base conjuguée varie de la même manière. Les deux solutions d'acides faibles comparés ont la même concentration. L'acide faible le plus fort est celui qui a le plus petit pKa. C'est à dire l'acide salicylique.
|
||||||
|
|
|