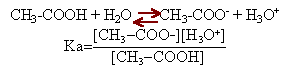| |
le chou rouge (Antilles bac sept 98)
|
||||||||||||||||||||||||||
|
indicateur coloré dosage acide faible base forte
|
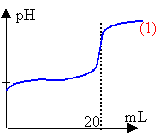
Le jus de chou rouge a une couleur qui dépend du pH.
4. La figure , ci-après, obtenue avec un logiciel, présente la simulation du même dosage. Les courbes tracées représentent les variations du pH en fonction du volume de soude ajoutée et les pourcentages des espèces acide éthanoïque et ions éthanoate en fonction de Vb 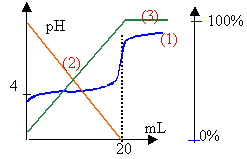 Que peut-on dire des concentrations molaires volumiques des espèces acide et base conjuguées présentes dans le mélange au point d’intersection des courbes 2 et 3 ? En déduire une valeur approchée du pKadu couple acide éthanoïque / ion éthanoate. Identifier les courbes 2 et 3. Justifier la réponse.
|
||||||||||||||||||||||||||
| |
La solution C qui donne une couleur jaune avec ce même jus est basique . Les 2 solutions acides A et B ont des concentrations molaires volumiques (0,1 mol/L) pour un acide fort : pH=-log(c) =-log(0,1) =1 B est donc un acide fort par contre le pH de A est bien supérieur à 1 : donc A est un acide faible partiellement dissocié en solution.
diluer 10 fois la solution d'acide éthanoïque à 0,1 mol / L : pour préparer 100 mL de solution diluée, prélever à l’aide d’une pipette jaugée surmontée d ’un pipeteur 10 mL de la solution mère. Verser dans une fiole jaugée de 100 mL et compléter avec de l'eau distilée jusqu'au trait de jauge.
La burette contient la solution de soude. l'erlenmeyer, placé sous la burette, contient les 20 mL d'acide éthanoïque dilué, l'indicateur coloré et de l'eau distilée afin que la sonde du pHmétre soit imergée. Un agitateur magnétique est placé sous l'erlenmeyer. CH3-COOH + HO- donne CH3-COO- + H2O (réaction totale) A l'équivalence les quantités de matière des réactifs mis en présence sont proportionnelles aux coefficients de l'équation bilan. Ca Va = Cb Vb (monoacide et monobase) la courbe de dosage donne Vb=20 mL Ca = 20*0,01 /20 =0,01 mol/L le pH à l'équivalence d'un dosage acide faible base forte est supérieur à 7, proche de 8 dans ce cas. Le chou rouge passe du bleu au vert aux environs de pH =8 ou 9 : le chou rouge peut être utilisé comme indicateur coloré pour repérer l'équivalence du dosage précédent. Lorsque la concentration de l'acide faible est égale à la concentration de sa base conjuguée, alors le pH de la solution est égal au pKa du couple acide base . La lecture du graphe indique pKa voisin de 5 à l'intersection des courbes (2) et (3). La courbe (2) donne le pourcentage de l'acide en solution : à pH inférieur au pKa, la forme acide prédomine La courbe (3) donne le pourcentage de la base conjuguée, ion éthanoate. Celle ci prédomine à pH supérieur à pKa.
|
||||||||||||||||||||||||||
|
|
|