| |
entretien des lentilles cornéennes (France bac juin 97)
|
||||||||||
|
|
catalyse hétérogène vitesse temps de demi réaction |
Les lentilles de contact souples doivent être retirées quotidiennement. Leur entretien se fait en deux étapes : une décontamination par une solution de peroxyde d'hydrogène(ou eau oxygénée) pour éliminer les germes pathogènes, suivie de la décomposition du peroxyde d'hydrogène pour que la lentille puisse être remise, sans danger, au contact de l'œil. On se propose d'étudier, en présence d'un catalyseur, la cinétique de la décomposition du peroxyde d'hydrogène contenu dans une solution utilisée pour la décontamination des lentilles de contact. Données : Etiquettes de la solution commerciale de décontamination :- peroxyde d'hydrogène stabilisé : 3,10 g ;- eau purifiée ajoutée pour arriver à un volume total de solution de 100 mL. Masses molaires atomiques : H = 1,0 ; O=16 g.mol-1. Volume molaire des gaz dans les conditions de l'expérience :Vm = 24 L.mol-1. Préparation de la solution S :
Présentation des catalyseurs utilisés pour la décomposition du peroxyde d'hydrogène : On utilise parallèlement deux catalyseurs :- le platine solide, déposé sous forme de poudre sur un support de plastique ;- une enzyme, la catalase, soluble en solution aqueuse.
Etude cinétique de la réaction. L'étude est menée à la température ambiante. A l'instant t = 0, on introduit : - le platine dans un échantillon de solution S, noté 1 ; - la catalase dans un échantillon de solution S, noté 2. Les volumes des deux échantillons sont égaux à Vs = 50 mL. Dans chaque échantillon, le peroxyde d'hydrogènese décompose en eau et en dioxygène suivant l'équation-bilan : On détermine à divers instant le volume de dioxygène dégagé et on en déduit la concentration en peroxyde d'hydrogène restant. On trace la courbe donnant la concentration en peroxyde d'hydrogène restant en fonction du temps, [H2O2]=f(t) 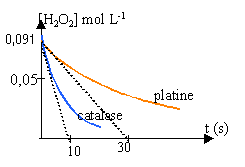
|
|||||||||
| |
la solution commerciale est diluée 10 fois donc prélever 20 mL de la solution du commerce à la pipette et placer dans une fiole jaugée de 200 mL catalyseur: augmente la vitesse d'une réaction mais il n'apparaît pas dans le bilan. Le platine solide plonge dans un liquide donc catalyse hétérogène.
Quantité de matière d'eau oxygénée restant à la date t : 4,55 -x= 4,55- V / 12 concentration de H2O2 à la date t : (4,55- V / 12) /50 = 0,091 - V/600 avec V en mL (O2 dégagé) (1) vitesse de disparition de l'eau oxygénée à la date t = - variation de la concentration H2O2 / durée de la variation Une vitesse étant toujours positive, on introduit un signe moins car la variation de la concentration d'un réactif est négative. Expérimentalement on mesure le volume de dioxygène dégagé et on utilise la formule (1) ci dessus. tracer la tangente à la date t aux courbes données, puis chercher le coefficient directeur de ces tangentes vitesses initiales de décomposition de l'eau oxygénée 0,091 / 10 = 0,0091 mol L-1 s-1. (catalase) 0,091 / 30 = 0,003 mol L-1 s-1. (platine) La concentration d'un réactif diminue au cours du temps; en conséquence la vitesse diminue au cours du temps. temps de demi réaction : durée au bout de laquelle la moitié de la quantité de matière du réactif limitant a disparu. (lecture graphique en traçant une horizontale passant par 0,045) catalase : t1/2 voisin de 8 s platine : t1/2 voisin de 25 s la catalase permet une décontamination beaucoup plus rapide que le platine.
|
||||||||||
|
|
|