| |
chimie acide base
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
mélange KOH et KNO3 |
Quel volume V1 d'une solution aqueuse de nitrate de potassium de formule KNO3,de concentration C1=0,025 mol.L-1, faut-il ajouter à 150 mL de So pour obtenir une solution de pH=12,15.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
[OH-]fin = 0,05*0,15 /(0,15+V1)= 0,0075 /(0,15+V1) pH=12,15 {H3O+]=10-12,15 =7 10-13 mol L-1. [OH-]fin =10-14 / 7 10-13 = 0,0141 mol L-1. 0,0141 =0,0075 /(0,15+V1) d'où V1=0,38 L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
courbes de neutralisation |
On neutralise 25 cm3 d'un acide A par la soude 0,41 mol/L. Pour determiner le volume d'equivalence, on suit l'evolution du pH en fonction du volume de soude versé. solution HCl
solution H3PO4
solution acide éthanoïque
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
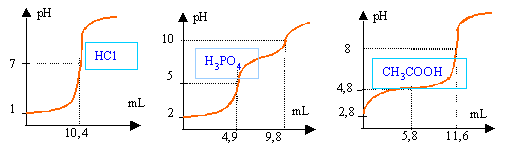
A l'équivalence : HCl : 25*Ca=10,4*0,41 d'où Ca=0,17 mol L-1. acide phosphorique , à la première équivalence, on a dosé une acidité : 25*Ca=4,9*0,41 d'où Ca=0,08 mol L-1 acide éthanoîque : 25*Ca=11,6*0,41 d'où Ca=0,19 mol L-1. à la demi équivalence, le pH est égal au pKa .
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
mélange d'acide |
On mélange dans l'eau de manière à avoir 1 L de solution :
La mesure du pH de la solution donne pH=4,25.
corrigé |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
conservation de la matière [AH]+[A-]=1 pH = pKa(AH/A-)+log[A-]/[AH] donne [A-]/[AH] = 0,356 résolution de ces 2 équations : [AH]=0,74 mol/L et [A-]=0,26 mol/L
initialement, avant réaction acide base, l'acide benzoique est essentiellement sous forme AH la soude réagi avec les 2 acides formique et benzoique et donne des ions formiate et benzoate. le calcul précédent indique 0,26 mol d'ion benzoate donc 0,26 mole d'acide benzoique a réagi avec 0,26 mol de soude AH + HO- donne A- + eau
0,74 mol de soude a réagi avec 0,74 mol HCOOH pour former 0,74 mol HCOO- pH=pKa(HCOOH/HCOO-) +log (0,74/0,26) pKa acide formique/ion formiate =4,25-0,45=3,8 De deux acides faibles ayant la même concentration, le plus fort est celui qui a le plus petit pKa.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|